A、B、C、D、E都是短周期元素,原子序数逐渐增大,原子半径按B、A、E、D、C依次增大。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是__________。
(2)甲物质的电子式是________ __。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中反应的离子方程式是 。
(4)用电子式表示A的气态氢化物的形成过程 。
A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为。
(2)由A、B、W三种元素组成的18电子微粒的电子式为。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和衡稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式。
(5)元素D的单质在一定条件下,能与A单质化合生成一种氯化物DA,熔点为800℃DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气全的体积是(标准状况下)。
(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为
。
肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。它的核磁共振氢谱图上有6个峰,峰面积之比为1:2:2:1:1:3。它的红外光谱如下图: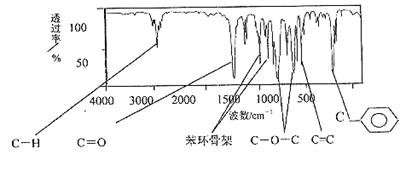
试回答下列问题:
(1)肉桂酸甲酯的结构简式是。
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示(图中球与球之间连线表示单键或双键)。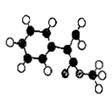
用芳香烃A为原料合成G的路线如下:
①化合物E中的官能团有(填名称)。
②A→B的反应类型是。
③化合物F是否有顺反异构体(填“有”或“没有”)。
④书写化学方程式
C→D。
E→H。
⑤E的同分异构体甚多,其中有一类可用通式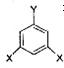 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应和遇氯化铁溶液发生显色反应的2种物质的结构简式、。
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应和遇氯化铁溶液发生显色反应的2种物质的结构简式、。
(1)环境专家认为可以用金属铝将水体中的NO 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO 、N2,请将各粒子分别填入以下空格内(不用配平)。
、N2,请将各粒子分别填入以下空格内(不用配平)。
该反应过程中,被氧化与被还原的元素的物质的量之比为。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。电池正极的电极反应式为;正极材料采用了铂网,利用铂网为正极的优点是。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g)△H=-2834.9kJ/mol
Fe2O3(s)+ C(s)=
C(s)=  CO2(g)+2Fe(s)△H=234.1kJ/mol
CO2(g)+2Fe(s)△H=234.1kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:
则反应过程中产生氢气的总体积为L(标准状况)。
工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下: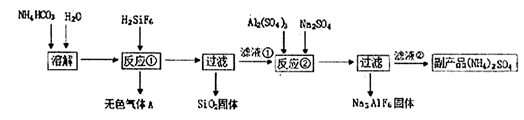
请回答下列问题:
(1)反应①中生成的无色气体A是,滤液①的溶质是。
(2)经测定NH4HCO3溶液呈中性,请分析原因(用离子方程式和文字表述说明理由)
。
(3)经反应②后,过滤得到的冰晶(Na3AlF6)固体,该固体上附着有杂质,需要洗涤,请简述如何证明冰晶石固体已经洗涤干净。
(4)温度和NH4HCO3浓度会影响反应①的速率。现设计如下实验方案探究温度和NH4HCO3浓度对反应①速率的影响。请在表格空白处填写适当的反应条件。
| 实验编号 |
实验目的 |
温度 |
c(NH4HCO3) |
| I |
为以下实验作参照 |
60℃ |
c1 |
| II |
探究浓度对反应①速率的影响 |
c2 |
|
| III |
探究温度对反应①速率的影响 |
80℃ |
(5)下图是滤液①溶质的质量分数随温度变化的曲线图: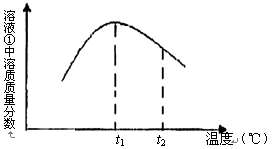

请分析t2℃时,滤液①中溶质的质量分数下降的原因是。
近期研究证实,中药甘草中的异甘草素在药理实验中显示明显的促进癌细胞凋亡和抑制肿瘤细胞增殖的活性,且对正常细胞的毒性低于癌细胞。异甘草素可以由有机物A和有机物B合成(A、B均为芳香族含氧衍生物),且由A和B合成异甘草素要用到以下反应:
请回答下列问题:
(1)有机物B分子式为C7H6O2,A和B均能与浓溴水反应生成沉淀。A和B具有一种相同的含氧官能团,其名称为;B的核磁共振氢谱有四个峰,峰面积之比是2:2:1:1。以下说法正确的是(填序号)。
①有机物B能发生很多类型的反应,例如:中和、取代、氧化、还原、加成反应;
②与B互为同分异构体的芳香族含氧衍生物共有两种(不含B);
③B能与碳酸氢钠溶液反应放出二氧化碳气体。
(2)质谱表明有机物A相对分子质量为152,其碳、氢、氧元素的质量分数比为12:1:6。有机物A的分子式为;已知A分子中的官能团均处于间位,写出A、B合成异甘草素的化学方程式。
(3)初步合成的异甘草素需要经过以下处理工艺;
I加入一定量的水,再加入一定量的乙醚提取2次
II用无水MgSO4干燥、过滤减压蒸出。
III洗涤、浓缩得黄色粉末,再用含水乙醇处理得黄色针状晶体。
步骤II蒸出的物质可能是。以上处理工艺中涉及的分离提纯操作依次有。
(4)有机物D符合下列条件,写出D的结构简式。
①与A互为同分异构体,且能发生水解反应
②1molD能与3moNaOH反应
③苯环上的氢被氯取代的一氯代物有两种
(5)有机物B还可以发生以下变化:
已知:F的单体是由E和 按1:1生成,请写出E→高分子化合物F的化学方程式。
按1:1生成,请写出E→高分子化合物F的化学方程式。