化学实验
I.(1)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重,为了将石蜡和碳酸钙溶出,应选用的试剂是__________。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d.正己烷
(2)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出_____________________,目的是:__________________________________________________________。
Ⅱ.实验室制备氯气的装置如下图。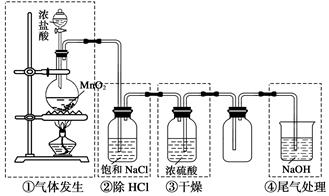
(1)装置①中发生离子反应方程式:_______________________________________;
(2)①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。所得的氯气:①__________② (填写<、>、=);
(3)上述装置不合理的是:______________(填写装置序号)。
Ⅲ某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。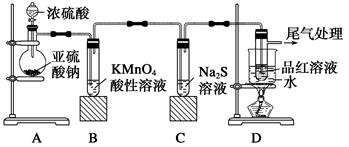
(1)装置A中发生反应的化学方程式为______________________________________;
(2)装置B中反应的离子方程式为_______________________________________。
某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应.其中D为纯净干燥的氯气与纯净干燥氨气反应的装置.
请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是。
(2)装置E的作用是,橡胶管k的作用是。
(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是。
(4)装置F中试管内发生反应的化学方程式____。
(5)接入D装置的两根导管左边较长、右边较短,目的是______.
(6)整套装置从左向右的连接顺序是(j)接()()接(f)(g)接()()接()()接(a).
天然水是人类饮用水的主要来源。从天然水获得可以饮用的水一般须经过沉降悬浮物、杀菌消毒等步骤。
(1)沉降悬浮物要在水中加入絮凝剂,如将铝盐加入水中能达到净水目的,
原因是(用离子方程式表示)。
(2)氯气可用于自来水杀菌消毒剂,结合离子方程式和文字理由。
(3)新型水处理剂高铁酸钾 (K2FeO4)具有强的氧化作用和絮凝作用。工业上可通过以下流程制备高铁酸钾: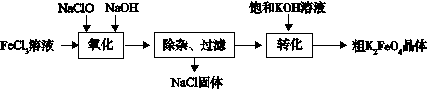
查阅资料:高铁酸盐在中性或酸性溶液中会逐渐分解,在碱性溶液中稳定。
完成“氧化”过程中的离子方程式
□Fe3+ + □ClO- +□="□" FeO42- + □Cl- +□
“转化”过程中实现由Na2FeO4制得K2FeO4,是利用二者性的不同。
③结合资料完成粗K2FeO4晶体的提纯:将粗产品用溶解,然后再加入饱和KOH溶液、冷却结晶、过滤。
④高铁酸钾的应用还在不断扩展中。如可制成高铁电池,电池反应为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时,正极反应为:。
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验: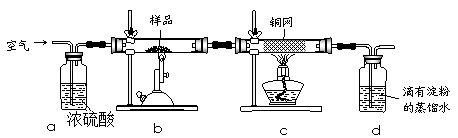
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
(1)称量样品所用的仪器为(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是。
(2)装置a和c的作用分别是和(填标号)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是。
(4)通过计算可知,该黄铜矿的纯度为。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是(填序号)。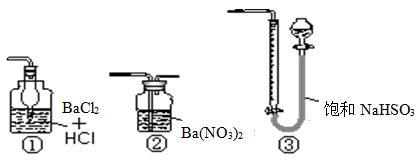
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有。
如图是一个制取氯气并以氯气为原料进行特定反应的装置。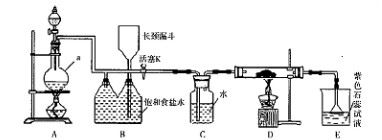
(l)A是氯气发生装置,写出其中的化学反应方程式。
(2)a仪器的名称为。
(3)实验开始时,先点燃A处的酒精灯,打开活塞K,让氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式,装置C的作用是。
(4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为。
(5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为(填序号)。
①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。
(6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2
产生,则装置B中的现象是;若发现装置B中该现象不明显,可能的
原因是;查找原因时可用肥皂水或湿润的碘化钾淀粉试纸等,若用蘸
有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程
式。
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:
甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
| 物质 |
沸点/℃ |
熔点/℃ |
密度(20℃) / g·cm-3 |
溶解性 |
| 甲醇 |
64. 7 |
 |
0. 7915 |
易溶于水 |
| 乙醚 |
34. 5 |
 |
0. 7138 |
微溶于水 |
| 3,5-二甲氧基苯酚 |
 |
33 ~36 |
 |
易溶于甲醇、乙醚,微溶于水 |
反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是的 。
②萃取用到的分液漏斗使用前需 并洗净,分液时有机层在分液漏斗的 填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是 ;用饱和食盐水洗涤的目的是 。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是 (填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先 ,再 。