某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。请填写下列空白:
[实验一]用如图所示装置,排水法收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成。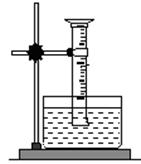
(1)该反应的化学方程式为 ;(只写第二步)
(2)水槽中盛放的液体最好为 ;(填标号)
| A.水 | B.饱和石灰水 | C.饱和食盐水 | D.饱和NaHCO3溶液 |
[实验二]用排蒸馏水法收集一试管甲烷和氯气的混合气体,光照反应后,
滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(3)该实验设计的错误之处
[实验三]步骤一:收集半试管氯气,加入10 mL 蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同)。测得pH = 3.26。
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40 W的日光灯下光照6 min后,加入10 mL 蒸馏水,充分振荡,测得pH=1.00。(4)判断该反应中有氯化氢生成的依据是 。
(5)假设氯气完全参与反应,且不考虑氯气溶解于水。往反应后的溶液中加水稀释到100.00 mL,取20.00 mL稀释液,加入10.00 mL浓度为0.01 mol·L-1的AgNO3溶液恰好完全反应,则试管中原有氯气在标准状况下的体积为 mL。
随着人们生活质量的不断提高,废电池进行集中处理的问题被提到议事日程,其首要原因是
| A.利用电池外壳的金属材料 |
| B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
| C.不使电池中漏泄的电解液腐蚀其他物品 |
| D.回收其中石墨电极 |
下列叙述不正确的是()
| A.Na、Mg、Al元素最高价氧化物对应的水化物碱性逐渐减弱 |
| B.P、S、Cl 元素与氢气化合条件逐渐变易 |
| C.N、O、F元素最高价氧化物对应的水化物酸性逐渐增强 |
| D.Li、Na、K原子的半径逐渐增大 |
元素性质呈周期性变化的决定因素是()
| A.元素的原子半径大小呈周期性变化 | B.元素相对原子质量依次递增 |
| C.元素原子的核外电子排布呈周期性变化 | D.元素的主要化合价呈周期性变化 |
下列叙述正确的是()
| A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 |
| B.除短周期外,其它周期均为18种元素 |
| C.ⅠA族的所有元素均为金属元素 |
| D.副族元素没有非金属元素 |
最近日本科学家确认世界上还存在的另一种“分子足球”N60,它与C60的结构相似。下列说法正确的是()
| A.N60是一种新型化合物 | B.N60和14N都是氮的同位素 |
| C.N60和N2是同素异形体 | D.N60和N2是同分异构体 |