钠和钾组成的合金4.6 g,与足量的水充分反应,得到H2的质量可能是( )
| A.0.29 g | B.0.18 g | C.2 g | D.1 g |
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是
| A.△H1>△H2>△H3 | B.△H1<△H3<△H2 | C.△H1<△H2<△H3 | D.△H1>△H3>△H2 |
可逆反应mA(固)+nB(气)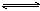 eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )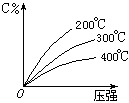
| A.达平衡后,加入催化剂则C%增大 |
| B.化学方程式中n>e+f |
| C.达平衡后,若升温,平衡右移 |
| D.达平衡后,增加A的量有利于平衡向右移动 |
下列关于强、弱电解质的叙述,有错误的是()
| A.强电解质在溶液中完全电离,不存在电离平衡 |
| B.在溶液中,导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
| C.强电解质都是离子化合物,弱电解质都是共价化合物 |
| D.纯净的强电解质在液态时,有的导电,有的不导电 |
工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ/mol,下列判断正确的是()
| A.反应物能量总和小于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(g) ΔH=+131.4 kJ/mol |
| C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
已知下列反应的热化学方程式为
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+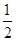 O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH为()
| A.-488.3 kJ/mol | B.-191 kJ/mol | C.-476.8 kJ/mol | D.-1 549.6 kJ/mol |