可逆反应A(g)+3B(g)  2C(g)+2D(g)。在四种不同情况下反应速率分别如下,其中反应速率最大的是 ( )
2C(g)+2D(g)。在四种不同情况下反应速率分别如下,其中反应速率最大的是 ( )
A.v(A)="0.15" mol/(L·min) B.v(B)="0.6" mol/(L·min)
C.v(C)="0.3" mol/(L·min) D.v(D)="0.1" mol/(L·s )
设NA表示阿伏加德罗常数的值.下列叙述正确的是
| A.标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物中所含的氯原子数介于NA至2NA之间 |
| B.0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L |
| C.0.2 mol•L﹣1 Na2S溶液中含有的S2﹣数目小于0.2NA |
| D.在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中每溶解1 mol Zn,转移的电子数大于2NA |
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
| A.甲的分子数比乙的分子数多 |
| B.甲的物质的量比乙的物质的量少 |
| C.甲的体积比乙的体积小 |
| D.甲相对分子质量比乙相对分子质量小 |
金属Ti(钛)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料。某化学兴趣小组用实验探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象如下:
| 金属[ |
Ti |
Mg |
Cu |
| 金属表面现象 |
放出气泡速度缓慢 |
放出气泡速度快 |
无变化 |
下列有关三种金属的说法正确的是
A.三种金属的活泼性由强到弱的顺序是Ti、Mg、Cu
B.若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D.Cu和稀盐酸不发生化学反应
对于某些离子的检验及结论一定正确的是
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C.先加入KSCN溶液无明显现象,再加入氯水,溶液变血红色,一定有Fe2+ |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g) C6H5CH=CH2(g)+H2 (g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),下图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系。下列说法正确的是
C6H5CH=CH2(g)+H2 (g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),下图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系。下列说法正确的是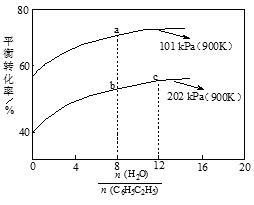
| A.a、b两点转化率不等,但是化学平衡常数相等 |
| B.b点转化率为50%,则混合气体中苯乙烯的体积分数为1/3 |
| C.恒容时加入稀释剂(水蒸气)能减小C6H5C2H5平衡转化率 |
| D.b点和c点温度和压强相同,故其反应速率也相等 |