常温下,浓度均为0.1 mol/L的4种溶液pH如下表:
| 溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
| pH |
11.6 |
9.7 |
10.3 |
4.0 |
下列说法正确的是
A.0.1 mol/L Na2CO3溶液加水,稀释后溶液中所有离子的浓度均减少
B.NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO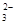 )
)
C.NaHSO3溶液中:c(Na+)>c(HSO3-) > c(H2SO3)>c(SO32-) > c(H+)>c(OH-)
D.向NaClO溶液中滴加硫酸至中性时,2c(SO42-)= c(HClO)
要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小相关。由此判断下列说法正确的是()。
| A.金属镁的硬度大于金属铝 |
| B.碱金属单质的熔、沸点从Li到Cs是逐渐增大的 |
| C.金属镁的熔点大于金属钠 |
| D.金属镁的硬度小于金属钙 |
下列有关金属键的叙述错误的是()。
| A.金属键没有饱和性和方向性 |
| B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用 |
| C.金属键中的电子属于整块金属 |
| D.金属的性质和金属固体的形成都与金属键有关 |
如图是CsCl晶体的晶胞结构(晶体中最小重复单元),已知晶体中两个最近的Cs+核间距离为a cm,氯化铯的式量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为()。
A. g·cm-3 g·cm-3 |
B.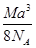 g·cm-3 g·cm-3 |
C.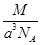 g·cm-3 g·cm-3 |
D. g·cm-3 g·cm-3 |
根据下列晶体的晶胞结构,判断化学式正确的是()。
某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是 ()。
A.3∶9∶4B.1∶4∶2
C.2∶9∶4D.3∶8∶4