已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是( )
| A.H2(g)的燃烧热为 -571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C.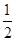 H2SO4(aq)+ H2SO4(aq)+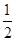 Ba(OH)2(aq)= Ba(OH)2(aq)= 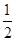 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)= CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1 |
下列各组物质的分类正确的是()
| A.同位素:1H+、2H2、3H | B.同系物:丙烷、异丁烷、新戊烷 |
| C.电解质:冰醋酸、水银、烧碱 | D.酸性氧化物:一氧化氮﹑二氧化碳、三氧化硫 |
下列叙述正确的是()
| A.明矾和ClO2常用于自来水的净化和杀菌消毒,两者的反应原理相同。 |
| B.盛放KOH溶液的试剂瓶不能用橡胶塞,应该用玻璃塞。 |
| C.北京时间3月11日日本发生9.0级地震,引起核泄漏,产生的粉尘中含有较多的131I,这是一种质子数为131的有放射性的碘的一种核素。 |
| D.冰岛火山喷发,火山灰在空气中几周都不能沉降,可能与胶体的性质有关。 |
同温同压下质量相同的X、Y两气体,已知V(Y)>V(X),则Mr(Y)和Mr(X)的关系()
| A.Mr(X)>Mr(Y) | B.Mr(X)<Mr(Y) | C.Mr(X)=Mr(Y) | D.无法确定 |
右图用交叉分类法表示了一些物质或概念之间的从属或包含关系,其中不正确的是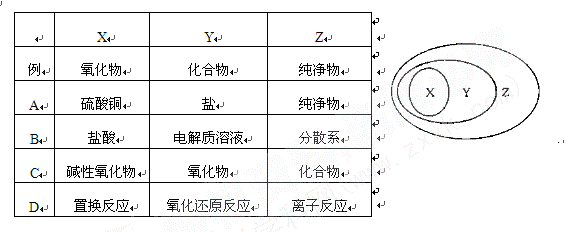
亚硝酸盐中毒,又名乌嘴病。亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法不正确的是()
| A.在中毒过程中血红蛋白被还原 | B.中毒时亚硝酸盐发生还原反应 |
| C.药品美蓝应具有还原性 | D.解毒时高铁血红蛋白被还原 |