某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。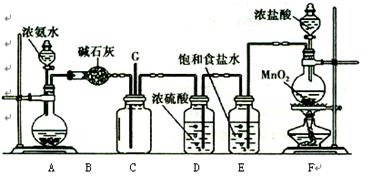
请回答下列问题:
(1)装置F中发生反应的离子方程式为 。
(2)装置A的烧瓶中可装试剂 。
(3)B装置的名称是 ;E装置的作用 。
(4)通入C装置的两根导管左边较长、右边较短,目的是
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式: 。当有a mol氯气参加反应时,转移的电子总数为b个,则伏加德罗数常数为(用含a、b的代数式表示)
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
。
根据Mg能在CO2中燃烧,某兴趣小组推测Na应该也能在CO2中燃烧,且固体产物可能为C、Na2O和Na2CO3中的两种或三种。该小组用如下图装置进行了实验探究。已知PdCl2能被CO还原得到黑色的Pd。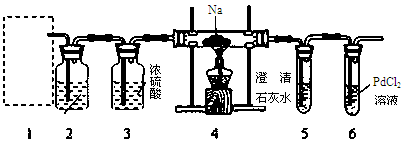
回答下列问题:
(1)为了使反应随开随用,随关随停,上图虚线方框内应选用装置(填下图字母代号),如何检验所选装置的气密性。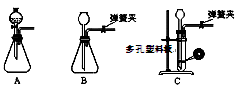
(2)装置2中所盛试剂为。
A.NaOH溶液B.饱和NaHCO3溶液
C.饱和Na2CO3溶液D.饱和NaCl溶液
(3)检测装置的气密性完好并装好药品后,在点燃酒精灯前应先进行装置1中的反应操作,待观察到现象时,再点燃酒精灯,这步操作的目的是。
(4)由实验现象和进一步的探究得出反应机理。
A.装置6中有黑色沉淀生成;
B.取反应后直玻管中的固体物质23.0g溶于足量的水中,无气泡产生且得到澄清的溶液;将溶液加水稀释配成250 mL的溶液;
C.取25.00ml步骤B的溶液,滴加足量BaCl2溶液,将生成的白色沉淀过滤、洗涤、干燥,称量得固体质量为1.97g。
①步骤C中不溶物干燥前必须经过洗涤,如何检验该沉淀是否洗涤干净。
②该探究得出钠与二氧化碳反应的化学方程式为。
硫酸亚锡(SuSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
II.SnC12易水解生成碱式氯化亚锡[Sn(OH)Cl]。
回答下列问题:
(1)SnC12粉末需要加浓盐酸进行溶解,请用化学方程式说明原因___________________。
(2)在SnC12溶液中加入Sn粉的作用有两个:①调节溶液pH②_________________。
(3)操作I中使用的玻璃仪器有___________________。
(4)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3,发生的反应为:SnCl2+ FeCl3= SnCl4+ FeCl2
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O
滴定时,K2Cr2O7溶液应该装在____________(填“酸式”或“碱式”)滴定管中。
若取2.0g锡粉,经上述各步反应后,共用去0.100mol/L K2Cr2O7溶液40.00mL,锡粉中锡的质量分数是____________________。
某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是______________________________。再由a向c中加2mL蒸馏水,c中的实验现象是_______________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____________,理由是_____________________________________。
(4)该小组同学向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸。观察到的实验现象是________________________;该小组同学实验目的是_________________,但此实验的不足之处是_____________________________。
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应过程如下,请回下列问题:
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是。
(2)在得到的FeSO4溶液中需加入少量的H2SO4酸化,目的是,得到K3[Fe(C2O4)3]溶液后,加入乙醇的目的是。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算。
步骤③需要在干燥器中进行的原因是;
步骤⑤的目的是。
(4) 可被酸性KMnO4溶液氧化放出CO2气体,所以实验产物中K3[Fe(C2O4)3]·3H2O含量测定可用KMnO4标准溶液滴定。
可被酸性KMnO4溶液氧化放出CO2气体,所以实验产物中K3[Fe(C2O4)3]·3H2O含量测定可用KMnO4标准溶液滴定。
①写出滴定过程中发生反应的离子方程式;
②下列滴定操作中使滴定结果偏高的是;
| A.滴定管用蒸馏水洗涤后,立即装入标准液 |
| B.锥形瓶在装待测液前未用待测液润洗 |
| C.滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
| D.读取标准液体积时,滴定前仰视读数,滴定后俯视读数 |
③取产物10.0g配成100mL溶液,从中取出20mL于锥形瓶中,用浓度为0.1mol·L-1酸性KMnO4溶液滴定,达到滴定终点时酸性KMnO4溶液消耗24mL,计算产物中K3[Fe(C2O4)3]·3H2O的质量分数。[已知摩尔质量M(K3[Fe(C2O4)3]·3H2O)=491g·mol-1]
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
(1)A中制取Cl2的离子方程式_______________________________________.
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和_____________________________;
假设2:存在三种成分:NaHCO3和_____________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为__________________。