下列离子方程式与所述事实相符且正确的是( )
| A.漂白粉溶液在空气中失效: ClO-+CO2+H2O=HClO+HCO3- |
B.用浓盐酸与MnO2反应制取少量氯气: MnO2+2H++2Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
| C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: |
3ClO-+2Fe(OH)3===2FeO42-+3Cl-+H2O+4H+
某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示: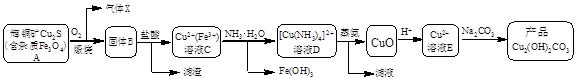
已知:[Cu(NH3)4]2+(aq)  Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
| A.气体X中含有SO2 |
| B.为实现溶液C到溶液D的转化,加NH3·H2O至红棕色沉淀刚好完全,过滤即可 |
C.蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4 ]Cl2 + H2O CuO + 2HCl↑+ 4NH3↑ CuO + 2HCl↑+ 4NH3↑ |
| D.在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低 |
大气中CO2含量的增多除了导致地球表面温度升高外,还会影响海洋生态环境。某研究小组在实验室测得不同温度下(T1,T2)海水中CO32-浓度与模拟空气中CO2浓度的关系曲线。下列说法不正确的是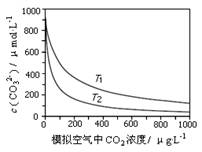
| A.T1>T2 |
| B.海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,导致CO32-浓度降低 |
| C.当大气中CO2浓度确定时,海水温度越高,CO32- 浓度越低 |
| D.大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解 |
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是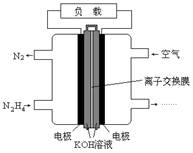
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.负极发生的电极反应式为N2H4 + 4OH- - 4e - = N2+ 4H2O |
| C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 |
下列说法正确的是
A.若完全燃烧,1 mol雄酮(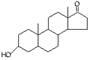 )比雌酮( )比雌酮(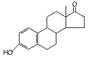 )多消耗3 mol O2 )多消耗3 mol O2 |
| B.正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 |
| C.蔗糖、麦芽糖和乳糖的分子式都为C12H22O11,均能发生银镜反应 |
| D.乙醇依次通过消去、取代、加成反应可生成乙二醇 |
五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。
| 元素代号 |
X |
W |
Y |
Z |
Q |
| 原子半径(×10-12 m) |
37 |
64 |
66 |
70 |
154 |
| 主要化合价 |
+1 |
-1 |
-2 |
+5、-3 |
+1 |
下列说法正确的是
A.由Q与Y形成的化合物中只存在离子键
Z与X之间形成的化合物具有还原性
C.由X、Y、Z三种元素形成的化合物,其晶体一定是分子晶体
D.Y与W形成的化合物中,Y显负价