某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示: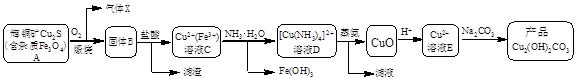
已知:[Cu(NH3)4]2+(aq)  Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
| A.气体X中含有SO2 |
| B.为实现溶液C到溶液D的转化,加NH3·H2O至红棕色沉淀刚好完全,过滤即可 |
C.蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4 ]Cl2 + H2O CuO + 2HCl↑+ 4NH3↑ CuO + 2HCl↑+ 4NH3↑ |
| D.在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低 |
核内中子数为N的R2+,质量数为A,则ng它的同价态氧化物中所含电子物质的量为
A.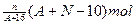 |
B.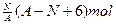 |
C.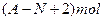 |
D.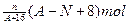 |
下图是可逆反应X2(g)+ 3Y2(g) 4Z2(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,
4Z2(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,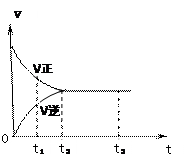
下列叙述正确的是
| A.t1时,只有正方向反应 |
| B.t2时,V正>V逆 |
| C.t2- t3,反应不再发生 |
| D.t2- t3,各物质的浓度不再发生变化 |
下列措施对增大反应速率明显有效的是
| A.Na与水反应时增大水的用量 | B.Fe与稀硫酸反应制取氢气时,改用浓硫酸 |
| C.在K2SO4与BaCl2两溶液反应时,增大压强 | D.将铝片改为铝粉,做铝与氧气反应的实验 |
已知可逆反应2SO2 + O2 2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应达平衡放出的热量为Q1,则
2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应达平衡放出的热量为Q1,则
| A.Q1 =" 0.5" Q | B.Q1 < 0.5 Q | C.2Q1 > Q | D.无法判断 |
可逆反应2SO2 + O2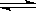 2SO3达到平衡的标志是
2SO3达到平衡的标志是
①消耗2 mol SO2的同时生成2 mol SO3② SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |