(本题共12分)下表是四种盐在不同温度下的溶解度(g/100g水):
| |
NaNO3 |
KNO3 |
NaCl |
KCl |
| 10℃ |
80.5 |
21.2 |
35.7 |
31.0 |
| 100℃ |
175 |
246 |
39.1 |
56.6 |
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
某同学设计用物质的量之比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图所示:

36、在①和②的实验过程中,需要控制的关键的实验条件是______________________,
在上述晶体中,______(填“A”或“C”)应为硝酸钾晶体。
37、在①的实验过程中,需要进行的操作依次是________________、________________、_____________。
38、粗产品中可能含有杂质离子_______________________,检验其中一种离子的方法是________________________________________________________________________。
39、为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是___________(填编号)。
a.热水 b.冰水 c.95%的酒精 d.四氯化碳
40、如取34.0g硝酸钠和29.8g氯化钾,加入70g水,在100℃蒸发掉50g水,维持该温度,过滤,析出晶体的质量为_______________。
有关元素X、Y、Z、W的信息如下:
请回答下列问题:
(1) Y的单质在空气 中充分燃烧所得氧化物的电子式________________
中充分燃烧所得氧化物的电子式________________
(2) X、Y、W的简单离子的半径由大到小的是_______________ (写离子符号)
(3) 向淀粉碘化钾溶液中滴加几滴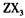 的浓溶液,现象为______________ ,
的浓溶液,现象为______________ ,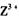 基态离子的电子排布式为
基态离子的电子排布式为
(4) 以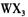 溶液为原料制取无水
溶液为原料制取无水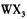 ,主要操作包括加热浓缩、冷却结晶、过滤,先制得
,主要操作包括加热浓缩、冷却结晶、过滤,先制得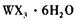 晶体,然后在条件下加热
晶体,然后在条件下加热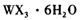 晶体,能进一步制取无水
晶体,能进一步制取无水 .其原因是(结合离子方程式简要说明) _____________________________________________
.其原因是(结合离子方程式简要说明) _____________________________________________
为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定上述(NH4)2 SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):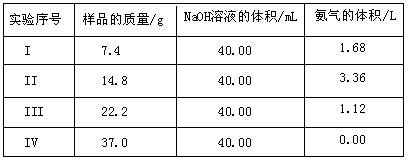
(1)实验过程中有关反应的离子方程式为
;
(2)由I组数据直接推测:标准状况下3.7g样品进行同样实验时,生成氨气的体积为
L;
(3)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比;
(4)欲计算该NaOH溶液的物质的量浓度应选择第组数据,由此求得NaOH溶液的物质的量浓度为。
已知A、B、C、D、E、F六种有机物存在如下转化关系, E在核磁共振氢谱中出现三组峰,其峰面积之比为6:1:1,F能使Br2的CCl4溶液褪色。回答下列问题: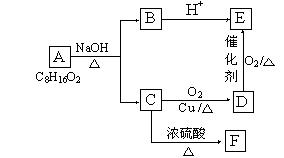
(1)C和E的官能团名称:C,E;
(2)由F生成高聚物的化学方程式
(3)六种有机物中能跟Na反应的是(填字母)
(4)由A生成B和C的化学反应方程式为
(5)D在一定条件下生成C的化学反应方程式为
根据下图所示的关系填空,已知A为FeS2固体,C的焰色反应火焰呈 黄色,其中①、③是硫酸工业生产中的重要反应,D、E常温下为气体,X常温下为无色液体,F是红棕色固体。
黄色,其中①、③是硫酸工业生产中的重要反应,D、E常温下为气体,X常温下为无色液体,F是红棕色固体。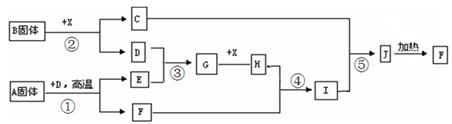
(1)物质X的化学式是 ____。
(2)化合物B中所包含的化学键有和 __。
(3)反应④的离子方程式为。
反应②的化学方程式为___ ___,其中还原剂是。
(4)已知每生成16克E,放出106.5KJ的热量,则反应①的热化学反应方程式为 ___。
下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生大量的白烟,D是海水中浓度最高的盐(部分反应物和生成物及溶剂水已略去)。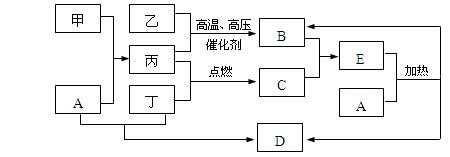
请回答下列问题:
⑴甲的化学式是,C的电子式为;
⑵写出A溶液和丁反应生成D的离子方程式:;
⑶写出A和E反应的化学方程式:。