常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全中和,则下列说法错误的是( )
| A.氨水的浓度等于盐酸的浓度 |
| B.原氨水中有1%的含氮微粒为NH4+ |
| C.氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍 |
| D.混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-4mol·L-1 |
有机物的种类繁多,但其命名是有规则的。下列有机物命名正确的是( )
A.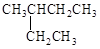 2—乙基丁烷 2—乙基丁烷 |
B. 二溴乙烷 二溴乙烷 |
C. 2—甲基丁烯 2—甲基丁烯 |
D.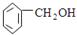 苯甲醇 苯甲醇 |
在某稀溶液中含有0.2molHNO3和xmolH2SO4,向其中加入19.2g铜粉,充分反应后产生的气体在标注状况下的体积为4.48L,则x值至少为
| A.0.6 | B.0.4 | C.0.3 | D.0.2 |
27.4g的Na2CO3与NaHCO3的固体混合物,在空气中加热片刻后固体混合物质量变为24g,将所得的固体混合物溶于200ml、2mol•L﹣1的稀盐酸恰好完全反应,并完全放出二氧化碳气体,将所得的溶液蒸干、灼烧称量,其质量为()
| A.11.7g | B.23.4 g | C.26.5g | D.58.5g |
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A.若X为O2,则A可为硫化氢
B.若X为KOH溶液,则A可为AlCl3
C.若X为Cl2,则C可为FeCl3
D.若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是()
| A.洗气瓶中产生的沉淀是碳酸钡 |
| B.从Z导管出来的气体中无二氧化碳 |
| C.洗气瓶中产生的沉淀是亚硫酸钡 |
| D.在Z导管口有红棕色气体出现 |