氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,
具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们
的晶体结构如图所示。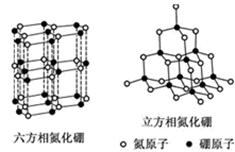
(1)关于这两种晶体的说法,正确的是 (填序号)。
| A.立方相氮化硼含有σ键和π键,所以硬度大 |
| B.六方相氮化硼层间作用力小,所以质地软 |
| C.两种晶体中B-N键均为共价键 |
| D.两种晶体均为分子晶体 |
(2)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为 ,其结构与石墨相似却不导电,原因是 。
(3)立方相氮化硼晶体,硼原子的杂化轨道类型为 。该晶体的天然矿物在青藏高原地下约300 km在古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是 。
(4)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 molNH4BF4含有 mol配位键。
在下列事实中,什么因素影响了化学反应的速率 ?
?
(1)夏天的食品容易霉变,冬天就不容易发生该现象。
(2)熔化的氯酸钾放出气泡很慢,撒入少量二氧化锰很快产生气体。
氢气在氯气中燃烧时产生的苍白色火焰。在反应过程中,断裂1molH2中的化学键消耗的能量为Q1 kJ,断裂1molCl2中的化学键消耗的能量为Q2 kJ,形成1molHCl中的化学键释放的能量为Q3 kJ,则Q1+ Q22 Q3(填“<”“>”“=”)。
在下列物质中:①碘单质②烧碱晶体③N aCl晶体④干冰⑤固态氯化氢。用序号填写下列空白:
aCl晶体④干冰⑤固态氯化氢。用序号填写下列空白:
(1)既含有离子键又含有共价键的化合物是 。
。
(2)含有离子键的化合物是 。
。
(3)仅含有共价键的单质是 。
。
请用元素符号(或化学式)回答原子序数11-18的元素有关问题:
(1)除稀有气体外,原子半径最大的是。
(2)最高价氧化物的水化物中碱性最强的是。
(3)最高价氧化物的水化物中呈两性的是。
(4)最高价氧化物的水化物中酸性最强的是。
(5)气态氢化物中最稳定的是。
在63Li、147N、2311N a、2412Mg、73Li、146C中,和互为同位素。表示核素的符号共种。
a、2412Mg、73Li、146C中,和互为同位素。表示核素的符号共种。