一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g) 2C(g),
2C(g),
经60 s达到平衡,生成0.6 mol C。下列说法正确的是
A.以A浓度变化表示的反应速率为0.001 mol·L-1·s-1
B.其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C.其他条件不变,若增大压强,则物质A的转化率减小
D.达到平衡时,C的体积百分含量为0.353
设NA为阿伏加德罗常数,以下叙述正确的是
| A.标准状况下,22.4L己烷中所含分子数为1NA |
| B.标准状况下,0.3 mol 干冰中所含分子数为0.3N A |
| C.常温常压下,11.2L甲烷中含有的氢原子数为2NA |
| D.1molNH4+所含有的质子数目为10NA |
某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物②煤和石油都是可再生能源③不锈钢和目前流通的硬币都是合金④硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物⑤蛋白质溶液、淀粉溶液和雾都是胶体。上述说法正确的是
| A.①③⑤ | B.①②④ | C.②③④ | D.③④⑤ |
向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入绿豆大小的金属钠,可能观察到的现象是 ( )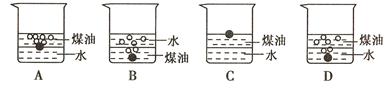
制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
| A.烧杯中有铜无铁 | B.烧杯中有铁无铜 |
| C.烧杯中铁、铜都有 | D.烧杯中铁、铜都无 |
在稀硫酸酸化的H2O2溶液中,加入乙醚后液体分层,再加入少量K2Cr2O7溶液并振荡,在乙醚层中出现深蓝色,这是因为反应生成的CrO5溶于乙醚所致。CrO5的结构如右 ,上述反应的离子方程式为:Cr2O72- + 4H2O2 + 2H+ ="=" 2CrO5 + 5H2O 。对以上实验事实分析中正确的是()
,上述反应的离子方程式为:Cr2O72- + 4H2O2 + 2H+ ="=" 2CrO5 + 5H2O 。对以上实验事实分析中正确的是()
| A.Cr2O72-被氧化为CrO5 | B.化合物CrO5中Cr为+10价 |
| C.该反应不属于氧化还原反应 | D.该反应中转移电子数为8e- |