常温下,将某一元碱BOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HCl的物质的量浓度 (mol·L-1) |
BOH的物质的量浓度 (mol·L-1) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=5 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.1 |
0.2 |
pH>7 |
请回答:
(1)从第①组情况分析,BOH是 (选填“强碱”或“弱碱”)。该组所得混合溶液中由水电离出的
c(OH—)= mol·L-1。
(2)第②组情况表明,c 0.2。该混合液中离子浓度c(B+) c(Cl—)(选填“<”、“>”或“=”)。
(3)从第③组实验结果分析,混合溶液中 (选填“<”、“>”或“=”)
甲:BOH的电离程度 BCl的水解程度
乙:c(B+)—2 c (OH—) c(BOH)—2 c(H+)
脂肪、淀粉、蛋白质被称为人类的三大营养物质,它们的共同性质是都与水发生________反应。我们从食物中摄取的蛋白质,在胃液中的胃蛋白酶和胰蛋白酶的作用下________反应,生成________,它被人体吸收后,重新合成人体所需要的各种________,人体内各组织的蛋白质不断分解,最后主要生成________排出体外。
某天然油脂A的分子式为C57H106O6。1 mol该油脂水解可得到1 mol甘油、1 mol不饱和脂肪酸B和2 mol直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C∶H∶O=9∶16∶1。
(1)写出B的分子式:__________________。
(2)写出C的结构简式:__________________;C的名称是____________________。
(3)写出含5个碳原子的C的同系物的同分异构体的结构简式:
________________________________________________________________________
________________________________________________________________________。
如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A.B.C都可以被强还原剂还原成为D(C6H14O6)。B脱水可得到五元环的酯类化合物E或六元环的酯类化合物F。
已知,相关物质被氧化的难易次序是:RCHO最易,R—CH2OH次之,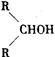 最难。请在下列空格中填写A.B.C.D.E、F的结构简式。
最难。请在下列空格中填写A.B.C.D.E、F的结构简式。
A:B:C:
D:E:F:
下图为硬脂酸甘油酯在碱性条件下水解的装置图。进行皂化反应的步骤如下: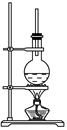
(1)在烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的NaOH、5 mL H2O和10 mL酒精。加入酒精的作用是________________________________________________________。
(2)图中长玻璃导管的作用是_______________________________________。
(3)该反应的化学方程式是______________________________________。
要检验淀粉的水解程度,提供了以下实验操作过程: ①取少量淀粉加水制成溶液 ②加热(水溶)③加入碱液,中和并呈碱性 ④加入银氨溶液 ⑤加入几滴稀硫酸 ⑥再加热 ⑦加入几滴碘水
请指出要达到下列实验目的所需正确操作过程的排列顺序:
(1)证明淀粉尚未水解____________;
(2)证明淀粉正在水解_____________ ;
(3)证明淀粉已完全水解_____________ 。