(14分)我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化
步骤及生成物未列出):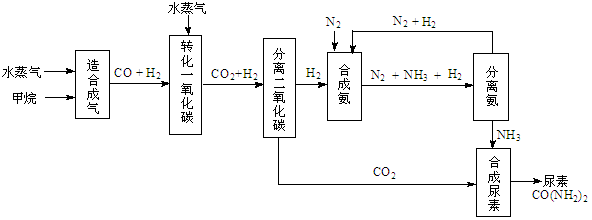
(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)  CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
(2)“转化一氧化碳”发生的方程式是H2O(g) +CO(g) 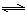 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
提高氢碳比[ n(H2O)/n(CO)],K值 (填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1∶3,此时v(正) v(逆)(填“>”、“=”或“<”)。
(3)有关合成氨工业的说法中正确的是 。
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3)∶n(CO2)的最佳配比为 ,而实际生产过程中,往往使n(NH3)∶n(CO2)≥3,这是因为 。
(5)当甲烷合成氨气的转化率为60%时,以3.0×108 L甲烷为原料能够合成 L 氨气。(假设体积均在标准状况下测定)
【化学选修2: 化学与技术】
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹。
(1)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定。工业上可以采用化学气相沉积法,在H2的保护下,使SiCl4与N2反应生成Si3N4沉积在石墨表面,写出该反应的化学方程式 。
(2)一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:
①净化N2和H2时,铜屑的作用是: ;硅胶的作用是 。
②在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度 ;体系中要通入适量的氢气是为了 。
③X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(3)工业上可以通过如下图所示的流程制取纯硅: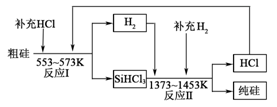
①整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应,写出该反应的化学方程式 。
②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%。则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用。
(1)请写出工业上由NH3制取NO的化学方程式 。
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+ CO2(g) FeO(s)+ CO(g),已知该反应的平衡常数K与温度T的关系如图所示。
FeO(s)+ CO(g),已知该反应的平衡常数K与温度T的关系如图所示。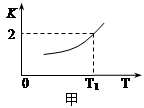
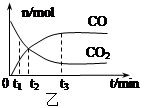
①该反应的逆反应是 (填“吸热”或“放热”)反应。
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是 。
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)= v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示。则CO2的平衡转化率为 ,平衡时混合气体的密度与起始时气体的密度之比为 。
(3)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特定见下表。
2NH3,有关数据及平衡状态特定见下表。
| 容器 |
起始投入 |
达平衡时 |
|||
| 甲 |
2 mol N2 |
3 mol H2 |
0mol NH3 |
1.5mol NH3 |
同种物质的体积分数相同 |
| 乙 |
a mol N2 |
b mol H2 |
0mol NH3 |
1.2mol NH3 |
起始时乙容器中的压强是甲容器的 倍。
(4)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量。生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 倍。请写出该反应的热化学方程式 。
倍。请写出该反应的热化学方程式 。
某晶体(结晶水合物)由五种短周期元素组成。常温下,将该晶体溶于蒸馏水后可电离出三种离子(忽略水的电离),其中两种离子含有的电子数均为10个。将该溶液分成等量2份,一份中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,产生白色沉淀;向另一份中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。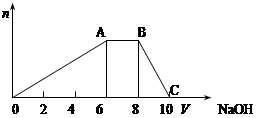
请回答下列问题:
(1)若该晶体的摩尔质量为906g·mol-1,写出该晶体的化学式 ;
(2)B点溶液的pH 7(填“<”、“>”或“=”),用化学用语表示其原因 。
(3)若向该晶体的水溶液中逐滴加入Ba(OH)2溶液至产生最多的沉淀,写出该变化的离子方程式 。
(4)C点溶液中所含溶质的化学式为 ;此时溶液中各种离子浓度由大到小顺序为 。
[化学——选修3:物质结构与性质]
下图分别是金刚石、石墨、足球烯和碳纳米管的结构示意图。图中小黑点或小黑圈均代表碳原子。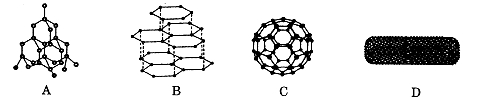
(1)四种物质互称为 。写出碳原子的基态电子排布图 。
(2)试比较:第一电离能I1(C)、I1(N)、I1(O)由大到小的顺序为 。
(3)石墨中存在的作用力有 。
A. 共价键 B. 金属键 C. 氢键
D. 配位键 E. 分子间作用力
石墨中碳原子采取的杂化方式是 。
(4)C的熔沸点比A (填“高”或“低”)原因是 。
(5)金刚石晶胞结构如下图所示,若金刚石的密度为ρ g·cm-3,试计算碳原子的半径为 pm(用含ρ式子表示,不必化简)。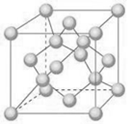
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
请回答下列问题:
(1)Fe位于元素周期表中第____________周期,第___________族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| TiCl4 |
Mg |
MgCl2 |
Ti |
|
| 熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
| 沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。