在一固定容积的密闭容器中,a mol/LN2和b mol/L H2反应,一定条件下经过2min达到平衡,生成c mol/L NH3.
求:(1)用H2表示的速率是多少?(2)N2的转化率是多少?
实验室制取Cl2的化学方程式为MnO2 + 4HCl 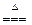 MnCl2 + Cl2↑+ 2H2O,当有146.0克HCl完全参加反时,有多少摩氧化剂被还原?有多少摩还原剂被氧化?还原产物为多少克?生成的氧化产物在标准状况下的体积是多少升?(每问3 分)
MnCl2 + Cl2↑+ 2H2O,当有146.0克HCl完全参加反时,有多少摩氧化剂被还原?有多少摩还原剂被氧化?还原产物为多少克?生成的氧化产物在标准状况下的体积是多少升?(每问3 分)
(1)现用氯化氢气体溶于水制取盐酸,要配制12mol∙L‒1的盐酸250mL,需要标准状况下的氯化氢气体多少升?
(2)取10克的碳酸钙与足量的盐酸充分反应,反应消耗HCl的物质的量是多少?同时生成标准状况下的气体体积及产物盐的质量分别是多少?
(3)已知质量分数为36.5%的盐酸,密度为1.18g ∙cm ‒3,则该盐酸的物质的量浓度是多少?
某抗酸药每片含碳酸钙534 mg、氢氧化镁180 mg。试计算10片该药片理论上可中和 1. 00 mol·L-1的盐酸溶液多少毫升恰好反应?
1. 00 mol·L-1的盐酸溶液多少毫升恰好反应?
一块表面已被氧化为Na2O的钠块8.5g,将其投入1L水中, 测得产生H2标况下体积为1.12L,通过计算求出未被氧化的钠与已被氧化的钠的质量比。(要求得出最简整数比)
测得产生H2标况下体积为1.12L,通过计算求出未被氧化的钠与已被氧化的钠的质量比。(要求得出最简整数比)
某温度下,将H2 和I2 各0.10mol的气态混合物充入10L的 密闭容器中,充分反应,经2分钟达到平衡,测得c(H2)=0.0080 mol•L-1。
密闭容器中,充分反应,经2分钟达到平衡,测得c(H2)=0.0080 mol•L-1。
(1)求:①H2转化为HI的转化率;②该反应的平衡常数。
(2)在上述温度下,该容器中若通入H2 和I2蒸气各0.20mol,试求达到化学平衡状态时各物质的浓度。