常温下,甲、乙、丙、丁四种气态烃的分子中所含电子数分别为10、14、16、18,下列关于这四种气态烃的推断正确的是( )
| A.四种气态烃中至少有两种互为同分异构体 | B.可以用酸性高锰酸钾溶液鉴别甲和丁 |
| C.丙分子中所有原子均在同一平面上 | D.乙和丁属于同系物 |
下列说法正确的是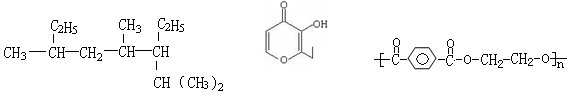
图1图2图3
| A.按系统命名法命名时,图1的名称是3,5,7-三甲基-6-乙基辛烷 |
| B.有机物(图2)的一种芳香族同分异构体能发生银镜反应 |
| C.等质量的乙酸甲酯和甲酸乙酯完全燃烧生成水的量相等 |
| D.高分子化合物( 10-3),其单体为对苯二甲酸和乙醇 |
X、Y、Z、W四种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为17。其中W的阴离子核外电子数与Z原子的最内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Y、Z均能形成双原子分子。根据以上叙述,下列说法中正确的是
| A.以上四种元素的原子半径大小为X<Y<Z<W |
| B.X2W2、W2Y、WZ均为直线型的共价化合物 |
| C.W与Y形成的化合物W2Y2在化学反应中既可作氧化剂也可作还原剂 |
| D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
下列说法不正确的是
| A.制阿司匹林时用水洗涤产品,而在制摩尔盐时用酒精洗涤产品 |
| B.纸层析法通常把不与水混溶的有机溶剂作为固定相 |
| C.中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 |
| D.减压过滤装置中,布氏漏斗的颈口斜面应与吸滤瓶的支管口相对,以便于吸滤 |
下列说法不正确的是
| A.“地沟油”经加工处理后,可用来制肥皂和生物柴油,可以实现厨余废物合理利用 |
| B.蔗糖、淀粉、油脂及其水解产物中既有电解质也有非电解质 |
| C.分光光度计可用于某些化学反应速率的实验测定 |
| D.分子间作用力比化学键弱得多,但它对物质溶解度影响较大,对熔点、沸点无影响 |
把200mL NH4HCO3和Na2CO3 的混合溶液分成两等份,取一份加入含amol NaOH的溶液恰好
反应完全;取另一份加入含bmol HCl的盐酸恰好反应完全。该混合溶液中c(Na+)为
| A.(l0b - 5a))mol/L | B.(2b-a)mol/L |
C.( )mol/L )mol/L |
D.(5b-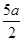 )mol/L )mol/L |