短周期元素X、Y、Z、W核电荷数依次增大,X、Z同主族,Z、W同周期,四种元素的原子序数之和为37,在周期表中X是原子半径最小的元素,Y的最外层电子数是内层电子数的3倍。
(1)W在周期表中的位置是 。
(2)X与Y 能形成具有18个电子的化合物,此化合物的电子式为 。
(3)X、Y、Z三种元素组成的化合物中存在的化学键类型为 。
(4)Z、W两种元素的最高价氧化物对应水化物溶液之间反应的离子方程式为 。
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g)=n Z(g)+6 W (g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol/(L·min),
(1)则这2 min内v(X) =v(W) =
(2)2 min末时Y的浓度
(3)化学反应方程式中n的值是
(4)2min末时,已用去的X占原 来总物质的量分数为
来总物质的量分数为
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。其中Z元素原子的核外电子总数是其最外层电子数的3倍。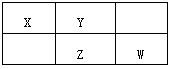
请回答下列问题:
(1)元素W位于周期表中第周期,族;
(2)这些元素的氢化物中,水溶液呈碱性的是(写化学式),
实验室检验这种氢化物通常采用的方法是______________________,
现象是____;
(3)XW2的电子式为;
(4)Z的最高价氧化物对应的水化物的化学式为;
A、B、C、D、E是常见化合物或单质,有如下转化关系(略去条件和副产品)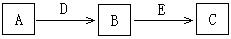
(1)若D为氧气,E为NaOH,C为NaAlO2,则单质A的名称为_______________________
B转化为C的化学方程式:____________________________________
(2)若A为气态单质,B为漂白粉的有效成份,C具有漂白性,则C的化学式为_____________
A转化为B的化学方程式:___________________________________
(3)若A、B、C均为钠盐的水溶液,D、E均为卤素单质,写出B转化为C的离子方程式:_______________________________
已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素,其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的+3价离子的3d能级为半充满状态。(答题时用ABCDE对应的元素符号表示)
(1)A的一种氢化物A2H2,其中心原子采取的杂化形式为___________,分子中含有___________个δ键,__________π键。
(2)写出化合物DC的电子式_____,E原子的核外电子排布式________。
(3)由E元素形成的金属的晶胞结构如右图,则该晶
胞中含有金属原子的数目为_______________。
(4)化合物E(CO)5常温下为液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断E(CO)5晶体属于__________(填晶体类型)。
X、Y、Z、Q、E五种元素中,X原子核外的M层中有2个单电子且与Z同主族,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为、;
(2)YZ2分子的立体结构是;
(3)Q的元素符号是,它的核外电子排布式为,在形成化合物时它的最高化合价为;
(4)E的氢化物的熔沸点比同族其它元素氢化物的熔沸点都要高很多,原因是