已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素,其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的+3价离子的3d能级为半充满状态。(答题时用ABCDE对应的元素符号表示)
(1)A的一种氢化物A2H2,其中心原子采取的杂化形式为___________,分子中含有___________个δ键,__________π键。
(2)写出化合物DC的电子式_____,E原子的核外电子排布式________。
(3)由E元素形成的金属的晶胞结构如右图,则该晶
胞中含有金属原子的数目为_______________。
(4)化合物E(CO)5常温下为液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断E(CO)5晶体属于__________(填晶体类型)。
氮及其化合物与人们的生活息息相关。
(1)氮元素在周期表中的位置是。
(2)实验室可用铜与稀硝酸反应制取NO,其离子方程式是。为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该钠盐的化学式是。
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=—574kJ·mol-1②CH4(g)+4NO2(g)=2N2(g)+CO2(g)+2H2O(g)△H=—1160kJ·mol-1
根据①和②,标准状况下,4.48LCH4恰好将NO2转化为N2时,△H=。
关于①和②,下列说法正确的是(填字母)。
a. 由于反应①可推知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)
△H<—574kJmol
b. 等物质的量的甲烷分别发生反应①、②,
转移电子数相同
c. 右图可表示①的反应过程和能量关系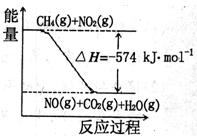
(4)同温同压下,3.5LNH3恰好将3.0L NO和NO2的混合气完全转化为N2,原混和气中NO和NO2的体积比是 。
。
短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
| 元素 |
有关信息 |
| X |
最外层电子数是次外层的2倍 |
| Y |
元素主要化合价为—2价 |
| Z |
其单质及化合物的焰色为黄色 |
| M |
与X同主族,其单质为半导体材料 |
| N |
 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
(1)XY2的电子式是;Z2Y2中所含化学键类型是;XY2与Z2Y2反应的化学方程式是。
(2)恒容条件下,一定量的NY2、Y2发生反应:2NY2(g)+Y2(g) 2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如右图,该反应的△H0(填“>”“<”或“=”,下同);若T1、T2时刻反应的化学平衡常数分别为K1、K2,则K1K2。
2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如右图,该反应的△H0(填“>”“<”或“=”,下同);若T1、T2时刻反应的化学平衡常数分别为K1、K2,则K1K2。
(3)X的非金属性比M(填“强”或“弱”),能证明此结论的事实是(用离子方程式表示)。
四种短周期元素A、B、C、D的性质或结构信息如下:
信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质:
请根据上述信息回答下列问题。
(1)B元素在周期表中的位置,请写出BC2分子的电子式。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式。
①A元素的单质与物质甲发生的反应。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中的现象是:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管底部出现红褐色沉淀。向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色。请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字。①②③。
最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
(1)分解池中发生分解反应的物质是。
(2)在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。
(3)①从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300°C的温度,原因之一是考虑到催化剂的催化活性,原因之二是。
②从合成塔中分离出甲醇的原理与下列哪个相符(选填字母)。
a.过滤 b.分液 c.蒸馏
③“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括。
(4)右图是甲醇燃料电池的结构示意图。已知电池总反应为:
2CH3OH+3O2=2C O2+4H2O。通入a—端的电极是(填“正极”或“负极”),负极发生的电极反应是。
O2+4H2O。通入a—端的电极是(填“正极”或“负极”),负极发生的电极反应是。
经质潜法分析得知,某单烯烃Q的相对分子质量为56;其核磁共振氢谱与红外光谱表明,Q分子中有两种化学环境不同的氢原子,氢蘑峰面积显示两种氢的原子个数比为1:3(Q分子中含有支链)。
(1)O的结构简式为。
(2)在锂离子电池中,需要一种有机聚合物作为正负极之问锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如右:
M的合成方法之一如下: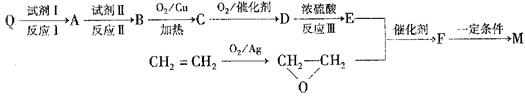
请回答下列问题:
①合成M的反应中,反应I和反应III的反应类型分别是、;
试剂Ⅱ是,C中含有官能团的名称是。
②E的结构简式是。
③M与足量氯氧化钠溶液反应的化学方程式是。
(3)D在一定条件下?能发生缩聚反应生成高聚物,请写出D发生缩聚反应的化学方程式。
(4)已知:I.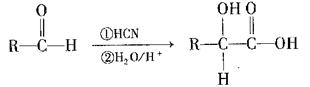 (其中R为烃基)
(其中R为烃基)
II.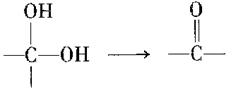
若 ,请写出符合下列条件的物质的一种结构简式。
,请写出符合下列条件的物质的一种结构简式。
a.碳骨架与w相同;
b.能发生银镜反应;
c.1mol该物质与足量金 属钠作用生成1.5molH2;
属钠作用生成1.5molH2;
d.分子中每个碳原子上不同时连有两个官能团。