为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验:
| 编号 |
操作 |
实验现象 |
| ① |
分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol·L-1 FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡 |
试管A中无明显气泡产生; 试管B中产生的气泡量增加 |
| ② |
另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 |
试管A、B中均未明显见到有气泡产生 |
请回答下列问题:
(1)过氧化氢分解的化学方程式为 。
(2)实验①的目的是___________________________________________________;实验中滴加FeCl3溶液的目的是________________________________________。
(3)实验②未观察到预期的实验现象。为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是_________________________(用实验中所提供的试剂或条件)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,分析判断OE、EF、FG三段中,___________段化学反应速率最快。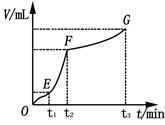
我市某化工厂排放的尾气中除含CO2外,还可能含有CO等气体。为确认CO气体是否存在,实验小组利用下列装置进行了检验,请回答下列问题: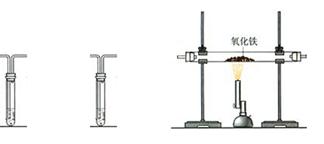
氢氧化钠溶液澄清石灰水
A B C
(1)在实验时,上述装置的连接顺序是:A → B →C→B。其中A装置的作用是,第一次B装置的作用为。
(2)若CO气体存在,则装置C中实验现象为 ,
,
反应的化学方程式为
 (3)从环境保护的角度考虑,你
(3)从环境保护的角度考虑,你 认为该实验的设计该如何改进?请写出一种改进方法:
认为该实验的设计该如何改进?请写出一种改进方法:
。
根据下列实验装置图回答(装 置用代号表示):
置用代号表示):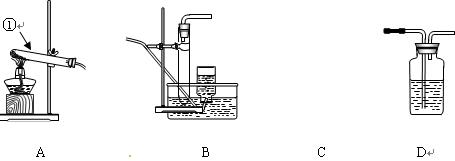
(1)写出编号为①的仪器名称____。
(2)实验室加热高锰酸钾制氧气时,应选用的发生装置是____;实验 室制二氧化碳时,应选用
室制二氧化碳时,应选用 的发生装置是____;检验二氧化碳气体可选用D装
的发生装置是____;检验二氧化碳气体可选用D装 置,其装置中盛放的试剂一般是____。
置,其装置中盛放的试剂一般是____。
(3)实验室加热高锰酸钾制取氧气有以下主要操作步骤:①加热②把药品装入试管后固定在铁架台上③检查装置的气密性④熄灭酒精灯⑤用排水法收集气体⑥从水槽中取出导管。正确的操作顺序是(写序号)____。
(14分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: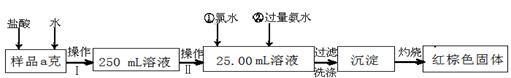
请根据上面流程,回答以下问题:
(1)操作I 所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有(填自选仪器名称),操作II 必须用到的仪器是(从以下选项中选择,填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.25mL碱式滴定管 | D.25mL酸式滴定管 |
(2)加入试剂①和②后发生反应的离子反应方程式为:
(3)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2="0.3" g,则接下来还应进行的操作是____________。
(4) 若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是:。
(5) 有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是:
(用化学方程式表示)
学习小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验:取适量牙膏样品,加水搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是____
____________________________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是_____
_____________________________________________________________________。
Ⅱ.牙膏样品中碳酸钙的定量测定:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。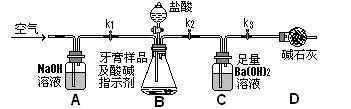
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有______
(4)C中反应生成BaCO3的化学方程式是__________________________
(5)下列各项措施中,不能提高测定准确度的是_________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体; b.滴加盐酸不宜过快;
c.在A—B之间增添盛有浓硫酸的洗气装置
d.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为_________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是
_________________________________________________________________________。
为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。
(1)请根据甲同学的意图,连接相应的装置,接口的顺序:b接______,_______接______,______接a。
(2)U形管中所盛试剂的化学式为_________________。
(3)装置③中CCl4的作用是________________。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在_______之间(填装置序号)。瓶中可以放入______________________________________________________。
(5)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中AgNO3溶液换成其它溶液。你认为可将溶液换成_____________,如果观察到_____________________的现象,则证明制Cl2时有HCl挥发出来。