欲配制100mL 1.0 mol/L Na2CO3溶液,正确的方法是( )
①将10.6 g Na2CO3 溶于100mL水中
②将28.6g Na2CO3·10H2O溶于少量水中,再用水稀释至100 mL
③将20 ml 5.0 mol/L Na2CO3溶液用水稀释至100 mL
| A.①② | B.②③ | C.只有② | D.①②③ |
下列叙述中,不能用平衡移动原理解释的是()
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| C.高压比常压有利于合成SO3的反应 |
| D.黄绿色的氯水光照后颜色变浅 |
在醋酸中存在电离平衡:CH3COOH 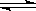 CH3COO-+H+,要使溶液中的c(CH3COO-)提高,应采取的措施是()
CH3COO-+H+,要使溶液中的c(CH3COO-)提高,应采取的措施是()
| A.加水 | B.加热 | C.加CH3COONa固体 | D.加很稀的NaOH溶液 |
反应:L(s)+aG(g)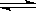 bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断()
bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断()
| A.上述反应 △H<0 | B.上述反应△H>0 |
| C.a>b | D.a<b |
对于可逆反应A(g)+2B(g)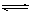 2C(g)(正反应吸热),下列图象中正确的是( )
2C(g)(正反应吸热),下列图象中正确的是( )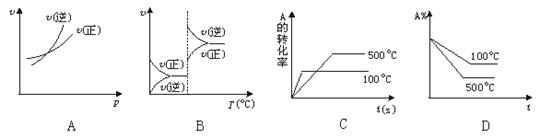
在密闭容中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是 ( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是 ( )
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.a < c+d | D.D的体积分数变大 |