高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)  Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为: K = c(CO2)/c(CO),已知1100 ℃时K =0.263。
Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为: K = c(CO2)/c(CO),已知1100 ℃时K =0.263。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值______;平衡常数K值______(选填“增大”“减小”或“不变”)。
(2)1100 ℃时测得高炉中c(CO2)="0.025" mol/L、c(CO)="0.1" mol/L,在这 种情况下,该反应是否处于化学平衡状态______(选填“是”或“否”),此时,化学反应速率是v正______v逆(选填“大于”“小于”或“等于”);
(3) 目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=—49.0 kJ·mol-1。现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=—49.0 kJ·mol-1。现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。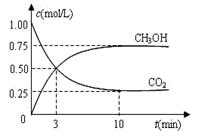
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________;
②若改变条件使平衡向正反应方向移动,则平衡常数______________(填序号)
| A.可能不变 | B.可能减小 | C.可能增大 | D.不变、减小、增大皆有可能 |
已知:C(s)+CO2(g) 2CO(g)△H>0。该反应的达到平衡后,下列条件有利于反应向正方向进行的是
2CO(g)△H>0。该反应的达到平衡后,下列条件有利于反应向正方向进行的是
| A.升高温度和减小压强 | B.降低温度和减小压强 |
| C.降低温度和增大压强 | D.升高温度和增大压强 |
一定条件下,将10 mol H2和1 mol N2充入一密闭容器中,发生反应:N2(g)+3H2(g) 2NH3(g),达到平衡时,H2的转化率可能是
2NH3(g),达到平衡时,H2的转化率可能是
| A.25% | B.30% | C.35% | D.75% |
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为
| A.A>B | B.A=10-4 B | C.B=10-4 A | D.A=B |
我们主要从三个方面讨论一个化学反应的原理,其中不属于这三个方面的是
| A.反应进行的方向 | B.反应的快慢 | C.反应进行的限度 | D.反应物的多少 |
已知重铬酸钾(K2Cr2O7)是一种比高锰酸钾还要强的氧化剂,其溶液中存在如下平衡:
2CrO42—(黄色)+2H + Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
若要使溶液的橙色加深,下列可采用的方法是
| A.加入适量稀盐酸 | B.加入适量稀硫酸 |
| C.加入适量烧碱固体 | D.加水稀释 |