(共14分)有A、B、C、D、E、F、G七种元素核电荷数依次增加,A是非金属元素外围电子排布式为nsn,B的价电子层电子排布nsnnpn,C的基态原子中2p轨道有三个未成对的单电子,D是周期表中电负性数值最大的元素, E原子核外电子数是D与C核外电子数之和,F是主族元素且与G同周期,G能形成红色(或砖红色)的G2O和黑色的GO两种氧化物,D与F可形成离子化合物,其晶胞结构如下图所示。请回答下列问题。
(1)E的气态氧化物EO3分子结构模型是 。
(2)CA3极易溶于水,其原因主要是 ,试判断CA3溶于水后,形成CA3·H2O的最合理结构为 (填字母)。
(3)从图中可以看出,D跟F形成的离子化合物的电子式为 ;该离子化合物晶体的密度
为ag· cm-3。,则晶胞的体积是 (只要求列出算式),每个D原子周围最近的F原子有 个。
(4)某科研小组为了处理污水,设计了如下图所示的的装置,Ⅱ装置为BA4燃料电池,两电极分别通入BA4和混合气体(空气和气体甲),电解质为熔融碳酸盐。Ⅰ是污水处理的装置,其方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。
①向污水中加入适量的H2SO4的目的是 ;
②为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为 Ⅱ装置中负极上发生的反应 ;
③Ⅰ装置中碳电极是电解池的 极,Fe电极上发生的反应为 ;
④Ⅱ装置中有0.8mol BA4参加反应时,C电极理论上生成气体的体积在标准状况下为 。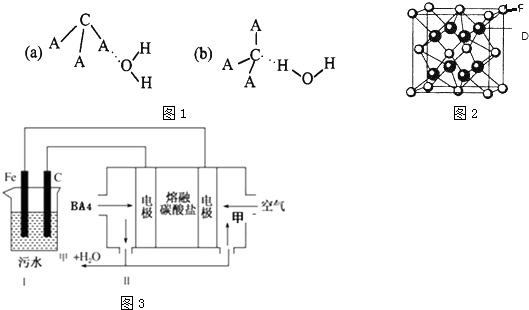
(15分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g) 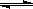 CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
,升高温度,K值(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a. 氢气的浓度减少 b. 正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加 d. 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:(用化学方程式表示)。
今有①盐酸②硫酸③醋酸三种酸:
(1)在同体积,同PH的三种酸中,分别加入足量的锌粉,在相同条件下产生H2的体积由大到小的顺序是____________
(2)在同体积、同浓度的三种酸中,分别加入足量的锌粉,在相同条件下产生H2的体积由大到小的顺序是____________
(3)物质的量浓度为0.1 mol·L—1的三种酸溶液的PH由大到小的顺序是_____________;如果取等体积的0.1 mol·L—1的三种酸溶液,用0.1 mol·L—1的NaOH溶液中和,当恰好完全反应时,消耗溶液的体积由大到小的顺序是_______________(以上均用酸的序号填写)。
某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,判断滴定终点的方法为____________ ______________________________________________
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗 净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,滴定结束时俯视读数 |
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:
则起始读数为_________mL,终点读数_____________mL;
(4)某学生根据三次实验分别记录有关数据如下:
|
| 滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
(填序号)(1)下列物质能导电的是____________,(2)属于强电解质的是_____________
(3)属于弱电解质的是________________,(4)属于非电解质的是__________________。
①铝片②石墨③KNO3晶体④盐酸⑤蔗糖
⑥CO2⑦Na2O⑧冰醋酸⑨BaSO4⑩氨水
实验:
(1)(4分)右图为实验室某浓盐酸 试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
①该浓盐酸中HCl的物质的量浓度为_________mol·L-1。
②取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_________ 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D溶液的密度
(2).实验室配制480mL0.08mol/LNa2CO3溶液回答下列问题
①应用托盘天平称取十水碳酸钠晶体_______g
② 若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______g(1g以下用游码)
③用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是
A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求
④若实验遇下列情况,溶液的浓度是“偏高”、“偏低”还是“不变”?
A.加水时越过刻度线_________
B.忘记将洗涤液加入容量瓶_________ _
_
C.容量瓶内壁附有水珠而未干燥处理____________
D.溶解后没有冷却便进行定容____________ __
__
(3)(8分)①取少量Fe2O3粉末(红棕色)加入适量盐酸,反应的离子方程式为______________,反应后得到黄色的FeCl3溶液。用此溶液做以下实验:
②取少量溶液置于试管中,滴入NaOH溶液,看到有红褐色沉淀生成, 反应的离子方程式为____________________________________。
反应的离子方程式为____________________________________。
③在小烧杯中加入25 mL蒸馏水,加热至沸腾后,向沸水中加入2 mL FeCl3饱和溶液,继续煮沸至溶液呈________色,即可制得Fe(OH)3胶体。
④另取一小烧杯加入25 mL蒸馏水后,向烧杯中再加入2 mL FeCl3饱和溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处,分别用激光笔照射烧杯中的液体,可以看到________(填甲或乙)烧杯中会产生丁达尔效应。此实验可以区别