二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是_____(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
②若上述反应中产生0.1mol ClO2,则转移电子的物质的量为_________0.1
mol。
(2)目前已开发出用电解法制取ClO2的新工艺。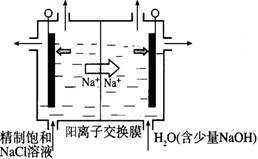
①右图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因________________。
(3)ClO2对污水中Fe2+、Mn2+、S2–和CN–等有明显的去除效果。某工厂污水中含CN– a mg/L,现用ClO2将CN–氧化,只生成两种气体,其离子反应方程式为 ;处理100 m3这种污水,至少需要ClO2 _______ mol。
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2 kJ,用H2表示的平均速率为。
(2)合成氨厂可用反应CO(g)+H2O(g) H2(g)+CO2(g)获得H2,已知该反应的平衡常数随温度的变化如下表,试回答下列问题:
H2(g)+CO2(g)获得H2,已知该反应的平衡常数随温度的变化如下表,试回答下列问题:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
①在800℃发生上述反应,向恒容反应器投入CO2、H2、CO、H2O的物质的量分别为:1 mol、1 mol、2 mol、2 mol,此时该反应由反应方向开始建立平衡。(选填“正”或“逆”)。
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的最大转化率为。
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有___________;
a.增加CO的用量 b.增加H2O(g)的用量
c.增大压强d.降低温度
(1)在下列空格上填出 “<” 或“>”
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=―Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=―Q2 kJ/mol Q1Q2
②对于平衡m A(g) n B(g)+ p C(g),若降低温度时, A 的转化率增大,则ΔH10;若减压后正反应速率小于逆反应速率,则mn+p。
n B(g)+ p C(g),若降低温度时, A 的转化率增大,则ΔH10;若减压后正反应速率小于逆反应速率,则mn+p。
③常温下pH=12的烧碱溶液与pH=12氨水分别加水稀释至pH=10,所加水的体积前者后者。
(2)向CuSO4溶液中加入足量氨水可以得到深蓝色溶液,溶液显深蓝色是由于生成了一种离子,请写出该离子的离子符号。
工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO + 2HCl=CuCl2 + H2O ,FeO + 2HCl = FeCl2 + H2O。
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀; pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中Fe2+,可采用的方法是。
(2)工业上为除去溶液中的_________。溶液的pH变化是。
(3)若此溶液只含Fe3+时,要调整pH在3~4之间,此时最好向溶液中加入。
(4)已知溶液中c(Cu2+)与溶液pH的关系为lg c(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1 mol/L,要保证此溶液中Cu2+刚好不发生Cu(OH)2沉淀,则溶液pH应为___________,此时溶液中的铁离子能否沉淀完全_________(填“能”或“否”)。
工业上制备BaCl2的工艺流程图如下:
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s)△H1 =" 571.2" kJ·mol-1①
4CO(g) + BaS(s)△H1 =" 571.2" kJ·mol-1①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s)△H2=" 226.2" kJ·mol-1②
2CO2(g) + BaS(s)△H2=" 226.2" kJ·mol-1②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =。
=。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是
A.c(HA)<c(A-)
B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-)
D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填:“能”或“不能”)大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是:。
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh= =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=。