(11分) (1)pH=13的CH3COONa溶液加水稀释100倍后,pH 11(填“>”“=”或“<”),原因是 (用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为 ;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 性,溶液中c(Na+) c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈 性,溶液中c(Na+)
c(CH3COO-)(填“>”“=”或“<”);
(4)25oC,用0.1000 mol / LNaOH溶液滴定20.00mL0.1000mol/L某一元酸HA溶液所得滴定曲线如右图。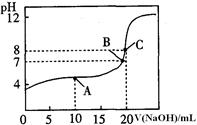
①为减小实验误差,由图可知滴定时指示剂应选用 (填“石蕊”、“酚酞”、“甲基橙”);
②A、B、C三点所示溶液导电能力最强的是 点对应的溶液;
③25OC,HA的电离平衡常数约为 。
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 |
实验目的 |
碳粉/ | 铁粉/ | 醋酸/% |
| ① |
为以下实验作参照 |
0.5 |
2.0 |
90.0 |
| ② |
醋酸浓度的影响 |
0.5 |
36.0 |
|
| ③ |
0.2 |
2.0 |
90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。
时,容器中压强明显小于起始压强,其原因是铁发生了腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了("氧化"或"还原")反应,其电极反应式是。
(3)该小组对图2中0~
时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有
的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
是锂离子电池中广泛应用的电解质。某工厂用
、
为原料,低温反应制备
,其流程如下:
已知:
的沸点是-85.0 ℃,
的沸点是19.5 ℃。
(1)第①步反应中无水
的作用是、。反应设备不能用玻璃材质的原因是(用化学方程式表示)。无水
有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中
极易水解,其产物为两种酸,写出
水解的化学方程式:。
(3)第④步分离采用的方法是;第⑤步分离尾气中HF、HCl采用的方法是。
(4)
产品中通常混有少量
。取样品
。测得
的物质的量为
,则该样品中
的物质的量为
(用含有
、
的代数式表示)。
酯(
)是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):
(1)
为加成反应,则
的结构简式是;
的反应类型是。
(2)
中含有的官能团名称是;
的名称(系统命名)是。
(3)
的化学方程式是。
(4)
是
的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(
)。
的结构简式是。
(5)下列说法正确的是。
a.
能和
反应得到聚氯乙烯的单体
b.
和
中均含有2个
键
c.1
完全燃烧生成7
d. 能发生加成、取代反应
是常见的六种元素。
(1)
位于元素周期表第周期第族;
的基态原子核外有个未成对电子;
的基态原子核外电子排布式为。
(2)用">"或"<"填空:
| 第一电离能 |
离子半径 |
熔点 |
酸性 |
(3)
与
反应生成
和一种黑色固体。在25 ℃、101
下,已知该反应每消耗1
,放热44.4
,该反应的热化学方程式是。
(4)
是常用于水的净化,工业上可用
氧化
溶液制取
。写出该反应的离子方程式,并标出电子转移的方向和数目。
PMMA俗称有机玻璃,是迄今为止合成透明材料中质地最优异的一种,其合成线路如下图所示: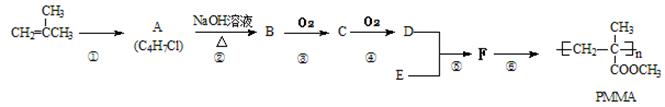
已知:在一定条件下可以发生如下反应:
(X代表卤素)
回答下列问题:
(1) F的结构简式为,所含官能团的名称是。
(2)写出A的结构简式,④的反应类型。
(3)写出③、⑤反应的化学方程式:
③,
⑤。
(4)有机物N能使溴水和酸性高锰酸钾褪色,且与有机物M互为同分异构体,请写出满足要求的所有N的结构简式。