是常见的六种元素。
(1)位于元素周期表第周期第族;的基态原子核外有个未成对电子;的基态原子核外电子排布式为。
(2)用">"或"<"填空:
| 第一电离能 |
离子半径 |
熔点 |
酸性 |
(3)与反应生成和一种黑色固体。在25 ℃、101下,已知该反应每消耗1,放热44.4,该反应的热化学方程式是。
(4)是常用于水的净化,工业上可用氧化溶液制取。写出该反应的离子方程式,并标出电子转移的方向和数目。
(8分)分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)
| 物质 |
需加入的试剂 |
有关离子方程式 |
| HNO3(H2SO4) |
||
| Cu(Fe) |
||
| ZnSO4(CuSO4) |
||
| NaCl(Na2CO3) |
(10分)(1)写出下列物质在水溶液中的电离方程式
氯化铜______________硫酸铁______________
(2)下列物质:①Na ② H2O ③酒精 ④CO2 ⑤NH3 ⑥Cu(OH)2⑦Ba(OH)2 ⑧冰醋酸(纯净的醋酸) ⑨蔗糖 ⑩NaCl溶液 ⑪BaSO4。
属于电解质的是, 属于非电解质的是 。(填序号)
(3)已知浓度为0.01mol·L-1的HCl溶液VmL,加水稀释到2VmL,取出10mL,则这10mL溶液中c(H+)mol/L。
(5分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A 萃取分液 B 蒸发结晶 C.分液 D.蒸馏 E、过滤
(1) 分离饱和食盐水和沙子的混合物。
(2) 分离水和汽油的混合物。
(3) 分离CCl4(沸点为76.75○C)和甲苯(沸点为110.6○C)的混合物。
(4) 将碘从碘水中提取出来。
(5) 从硫酸钾溶液中得到硫酸钾固体。
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
①在天平上称出27.8g绿矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入500mL容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度1~2cm处.改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为(填序号).
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是
、.
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会(填“偏高”、“偏低”或“无影响”).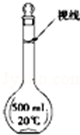
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:没有进行操作步骤④,会;加蒸馏水时不慎超过了刻度,会.向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,会.
(5)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应.
4分)某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为,可知所配成的盐酸溶液的物质的量浓度为.