I.设反应①Fe(s)+CO2(g)  FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。
反应②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,
FeO(s)+H2(g)的平衡常数为K2,
在不同温度下,K1、K2的值如下:
| T(K) |
K1 |
K2 |
| 973 |
1.47 |
2.36 |
| 1173 |
2.15 |
1.67 |
(1)现有反应③CO2(g)+H2(g)  CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。
A.缩小反应容器容积
B.扩大反应容器容积
C.降低温度
D.升高温度
E.使用合适的催化剂
F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)  FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)  FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=________mol·L-1,KW(25℃)________KW(100℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4HCO3固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 |
电离平衡常数(25℃) |
| HCN |
K=4.9×10-10 |
| CH3COOH |
K=1.8×10-5 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 ____。
②25 ℃时,相同浓度、相同体积的CH3COOH溶液和NaOH溶液混合, 则混合溶液中c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_______________________________。
在一只小烧杯里,加入20 g Ba(OH)2·8H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后加入10 g NH4Cl晶体,并用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是___ ____。
(2)写出有关反应的化学方程式: ____ ___ ,
该反应属_______反应(填基本反应类型)。
(3)实验中观察到的现象有__ _____ 、___ ____且反应混合物成糊状,反应混合物呈糊状的原因是____ ___ 。
(4)通过___ _现象,说明该反应为_______热反应,这是由于反应物的总能量__ ___ _
生成物的总能量(填“高”或“低”)
(9分)下表列出了①~⑦七种元素在周期表中的位置:
请按要求回答下列问题。
(1) 元素④的原子结构示意图是。
(2) 元素③与⑥形成的化合物中的化学键类型为。元素①与⑤形成的化合物的电子式为。
(3) 在相同条件下,元素②、③、④的单质分别与盐酸反应最缓慢的是(填写化学式);这三种元素最高价氧化物对应水化物中碱性最强的是(填写化学式);
(4)元素⑤、⑥、⑦的单质氧化性依次(填写“增强”或“减弱”),它们的气态氢化物中稳定性最弱的是(化学式)。
(5)将一小块元素②的单质放在石棉网上,用酒精灯微热,待其熔成球状时,将盛有元素⑥单质的集气瓶迅速倒扣在它的上方。写出该反应的化学方程式。

根据图示填空:
(1)化合物A含有的官能团是。
(2)1mol A与2 mol H2反应生成1mol E,其反应方程式是。
(3)与A具有相同官能团的A的同分异构体的结构简式是。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是。
(5)F的结构简式是。由E生成F的反应类型是。
Ⅰ.已知:
(烃基烯基醚)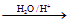
烃基烯基醚A的相对分子质量(
)为176,分子中碳氢原子数目比为3∶4 。与
相关的反应如下: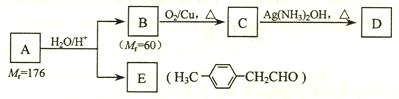
请回答下列问题:
⑴
的分子式为。
⑵
的名称是;
的结构简式为。
⑶写出
→
反应的化学方程式:。
⑷写出两种同时符合下列条件的E的同分异构体的结构简式:、。
①属于芳香醛;②苯环上有两种不同环境的氢原子。
Ⅱ.由
转化为对甲基苯乙炔(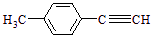 )的一条路线如下:
)的一条路线如下: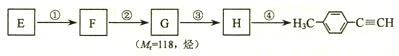
⑸写出
的结构简式:。
⑹写出反应所加试剂、反应条件:反应②反应③
(7)写出反应类型:反应①;反应④
按下图装置进行实验,并回答下列问题
⑴判断装置的名称:A池为__________池,B池为___________池。
⑵铜极为__________极,电极反应式为,
石墨棒C1为______极,电极反应式为________________________,
石墨棒C2附近发生的实验现象为______________________________。
⑶当C2极析出224mL气体(标准状态)时,左侧烧杯中溶液的质量_________(增加、不变或减少)_________g。