在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题: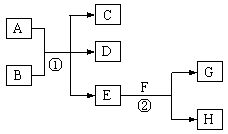
(1)在反应②中,每生成 2.24L 气体G(标准状况)时,该反应转移电子的物质的量是 mol。
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一元强碱,B是一种酸式盐,D是一 种使湿润红色石蕊试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。在加热条件下,当A过量时,反应①的离子方程式是 。
( 4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiCl4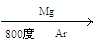 Ti
Ti
①C(s) + O2(g) = CO2(g); △H = -393.5 kJ•mol-1
②2CO(g) + O2(g) = 2CO2(g); △H = -566 kJ•mol-1
③TiO2(s) + 2Cl2(g) = TiCl4(s) + O2(g); △H =" +141" kJ•mol-1
则TiO2(s) + 2Cl2(g) + 2C(s)= TiCl4(s) + 2CO(g) 的△H = _________________。
(每空1分,共13分。)
(1)选择下列某种答案的序号,填入下表的空格。
①同位素②同素异形体③同分异构体④同系物⑤同种物质
| 物质 |
红磷 |
氯仿与 |
氕与 |
新戊烷与 |
2-甲基戊烷与 |
| 名称 |
与白磷 |
三氯甲烷 |
氘、氚 |
2,2-二甲基丁烷 |
2,3-二甲基丁烷 |
| 相互关系 |
(2)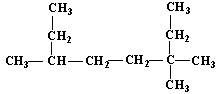 的名称为___________________________;
的名称为___________________________;
( 3)
3) 的名称为____________________________;
的名称为____________________________;
(4)2,4-二氯甲苯的结构简式为___________________________;
(5)反-2-戊烯的结 构简式为________________________________;
构简式为________________________________;
(6)某物质结构如图所示,其官能团是,;分子式为;
该物质可以与下列(填序号)发生反应。
A.酸性KMnO4溶液 B.氢气 C.溴水 D.NaOH溶液
B.氢气 C.溴水 D.NaOH溶液
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中。请回答: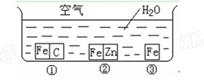
(1)铁被腐蚀的速率由快到慢的顺序是(填序号)。
(2)铁处于①环境时,正极反应式___________________________
(3)请你为以下钢铁制品选择适当的防锈方法。
A.自行车的链条、齿轮
B.海水中的轮船
环境和材料是现在社会中两大关注的问题,请回答:
(1)室内空气污染物主要包括CO、CO2、HCHO(甲醛)、C6H6(苯)等,在这四种污染物中,由建筑和装修产生的是_____________________。
(2)造成水体富营养化的主要原因是。
A.汞(Hg)、镉(Cd) B.N、P的化合物
C.石油泄漏 D .工厂
.工厂 排放酸、碱、盐
排放酸、碱、盐
(3)造成白色污染的主要原因是。
A.废塑料制品 B.废铝制易拉罐
B.废旧电池 D.生活垃圾
(4)为了治理汽车尾气的污染问题,可以在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成CO2和N2,写出该反应的化学方程式:。
(5)合金是被广泛应用的金属材料,下列有关合金性质的说法正确的是(填字母)
A.合金的熔点一般比它的成分金属高
B.合金的硬度一般比它的成分金属低
C.组成合金的元素种类 相同,合金的性能就一定相同
相同,合金的性能就一定相同
D.合金与各成分金属相比,具有许多优良的 物理、化学或机械性能
物理、化学或机械性能
(6)塑料、合成橡胶和是常说的三大合成材料。
随着生活水平的提高,人们越来越 关注自身的健康。请回答:
关注自身的健康。请回答:
(1)蛋白质是构成生命的基础物质,是日常膳食的重要组成部分。下列食物中富含蛋白质的是 。
A.苹果 B.白菜C.牛奶 D.米饭
(2)人体所需的营养物质中,水解后能生成高级脂肪酸和甘油的是;蛋白质水解的最终产物是;提纯蛋白质可以采用的一种方法是(填“盐析”或“过滤”)。
(3)向淀粉溶液中加入碘水 ,溶液呈色,再往该溶液中滴加维生素C溶液,现象是,该实验说明了维生素C具有性。下列有关维生素C说法不正确的是。
,溶液呈色,再往该溶液中滴加维生素C溶液,现象是,该实验说明了维生素C具有性。下列有关维生素C说法不正确的是。
A.蔬菜应先洗后切 B.蔬菜应小火慢煮 C.维生素C可使溴水褪色
(4)抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。
写出该抗酸药发挥功效时的离 子方程式:
子方程式:
、。
下表列出了①~⑥六种元素在周期表中的位置:
| 族 周期 |
ⅠA |
0 |
||||||
| 1 |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
||
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
请按要求回答下列问题。
(1)元素①的元素符号是。
(2)元素②的单质的电子式是。元素③与元素⑤形成化合物的电子式是。
(3)元素⑤的原子结构示意图是。
(4)这六种元素中,位于第三周期且原子半径最小的是(填元素符号)。
(5)这六种元素的最高价氧化物中,属于两性氧化物的是(填化学式)。
(6)在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为;向上述反应后的溶液中再加入元素④的单质,发生反应的化学方程式为。