随着生活水平的提高,人们越来越 关注自身的健康。请回答:
关注自身的健康。请回答:
(1)蛋白质是构成生命的基础物质,是日常膳食的重要组成部分。下列食物中富含蛋白质的是 。
A.苹果 B.白菜 C.牛奶 D.米饭
(2)人体所需的营养物质中,水解后能生成高级脂肪酸和甘油的是 ;蛋白质水解的最终产物是 ;提纯蛋白质可以采用的一种方法是 (填“盐析”或“过滤”)。
(3)向淀粉溶液中加入碘水 ,溶液呈 色,再往该溶液中滴加维生素C溶液,现象是 ,该实验说明了维生素C具有 性。下列有关维生素C说法不正确的是 。
,溶液呈 色,再往该溶液中滴加维生素C溶液,现象是 ,该实验说明了维生素C具有 性。下列有关维生素C说法不正确的是 。
A.蔬菜应先洗后切 B.蔬菜应小火慢煮 C.维生素C可使溴水褪色 
(4)抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。
写出该抗酸药发挥功效时的离 子方程式:
子方程式:
、 。
(1)在硝酸生产过程中所排放出来的废气中含有NO和NO2 ,它们污染环境,现用氨催化还原法将它们转化为无毒气体________(填化学式)直接排入空气中,写出有关反应方程式:________、________。
(2)假设NO和NO2 物质的量之比恰好为1∶1,则两者的混合物相当于一种酸酐,写出由烧碱溶液吸收这种酸酐的化学方程式________________________。
将还原性铁粉分别放入冷的浓H2SO4 、浓HNO3 中,开始都有大量气泡生成,后来反应不再发生。已知生成的气体有刺激性气味,H2SO4 中生成的气体呈无色,HNO 3 中生成的气体呈红棕色;剩余的固体经检验有磁性。试回答:
(1)Fe的氧化产物是________。(写化学式,下同)
(2)浓H2 SO4 的还原产物是________,浓HNO3 的还原产物是________。
某学生课外活动小组利用下图所示装置分别做如下实验: 
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液;加热时溶液由无色变为红色的原因是________________。
实验证明铜在低温下不能和O2 发生反应,也不能和稀H2 SO4 共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并不断通入空气来制取CuSO4 溶液的,铜屑在此状态下发生的一系列化学反应为:______________,______________。利用铜和浓H2 SO4 在加热条件下也能制备CuSO4 溶液,其化学方程式为______________。以上方法前者好还是后者好?原因是什么?_________________________ 。
2,4,5-三氯苯酚和氯乙酸反应可制造除草剂2,4,5-三氯苯氧乙酸。某生产该除草剂的工厂曾在一次事故中泄漏出一种有毒的二恶英,简称TCDD。有关物质的结构式如下: 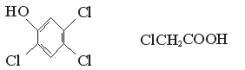
2,4,5-三氯苯酚氯乙酸 
2,4,5-三氯苯氧乙酸 TCDD
请写出:(1)生成2,4,5-三氯苯氧乙酸反应的化学方程式。
(2)由2,4,5-三氯苯酚生成TCDD反应的化学方程式。