草酸作为一种重要的化工原料,某学习小组的同学拟以甘蔗渣为原料用水解一氧化一水解技术制取草酸。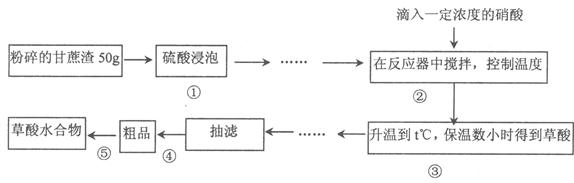
Ⅰ、步骤④是减压抽滤(见下图),其优点是:__________________________________________, 当抽滤完毕或中途停止抽滤时,为了防止自来水倒吸入B装置,最佳的操作是___________。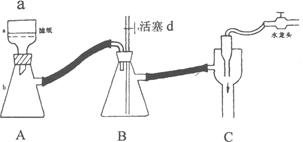
Ⅱ、该小组同学为了确定产品H2C2O4·xH2O中的的x值,进行下列实验:
①取w g产品配成100mL水溶液;
②量取25.00mL草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol·L-1KMnO4溶液滴定。 请回答下列问题:
(1)实验①中,需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和___________。
(2)写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:_____________________________。
(3)若滴定时,前后两次读数分别为a mL和b mL,由此计算出该草酸晶体的x值是__________
Ⅲ、该小组同学在做实验Ⅱ②时发现向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快,即反应速率由小变大。为此,他们设计了实验进行探究:
【实验用品】 仪器:试管(若干个并编号①,②,③…)、胶头滴管(若干支)、秒表
试剂:0.1 mol/L H2C2O4溶液、0.1 mol/L KMnO4溶液、稀硫酸、MnSO4固体
【实验内容】
实验(1):在①号和②号试管中分别先加入5m1 0.1mol/L H2C2O4溶液,然后各加10滴稀硫酸,且在②号试管中加入少量硫酸锰固体。再在两支试管中各加入5滴0.1mol/LKMnO4溶液。现象如下(表1)
| 编号 |
①号试管 |
②号试管 |
| 褪色时间 |
90s |
5 s |
| 实验现象 |
均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
实验(2):在①号和②号试管中分别加入5m1 0.1mol/L H2C2O4溶液,在②号试管中再滴加l0滴稀硫酸,然后在两支试管中各加入5滴0.1 mol/L 的高锰酸钾溶液。现象如下(表2)
| 编号 |
①号试管 |
②号试管 |
| 褪色时间 |
100 s |
90 s |
| 实验现象 |
均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
实验(3):在①号、②号和③号试管中分别加入5m1 0.1mol/L H2C2O4溶液,然后在①、②、③号试管中依次加入10滴、l mL、2 mL稀硫酸溶液,然后各加入5滴0.1 mol/L的高锰酸钾溶液,然后置于温度为65℃的水浴中加热。观察现象如下(表3)。
| 编号 |
①号试管 |
②号试管 |
③号试管 |
| 褪色时间 |
88 s |
100 s |
120 s |
| 实验现象 |
均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
(1)设计实验(1)对应的假设是_________________________________________________。
实验(1)得出的结论是____________________________________________________。
(2)由实验(2)和实验(3)得出的结论是_________________________________________m___。
某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H =-49.0 kJ·mol-1 测得CH3OH的物质的量随时间变化如图所示,回答问题:
CH3OH(g)+H2O(g) △H =-49.0 kJ·mol-1 测得CH3OH的物质的量随时间变化如图所示,回答问题: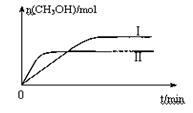
①该反应的平衡常数表达式为K=。
②曲线I、Ⅱ对应的平衡常数大小关系为KⅠKⅡ(填“大于”、“等于”或“小于”)。
③其它条件不变时,下列措施能提高H2转化率的是(填字母)。
| A.减小CO2的浓度 | B.降低温度 | C.增加H2的浓度 | D.增大压强 |
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(I)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s) + 3C(石墨) =2Fe(s) + 3CO(g) △H 1 =+489 kJ·mol-1
C(石墨) +CO2 (g) =2CO(g) △H 2 = +172 kJ·mol-1
则Fe2O3(s) + 3CO(g) = 2Fe (s) + 3CO2(g) △H=。
②利用燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为 电解质溶液),写出该电池的正极反式。
(II)如图所示,烧杯中都盛有稀硫酸。
(1)中反应的离子方程式为;比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是(用序号表示) 。
溶液配制是中学化学实验的基本操作。
(1)用氢氧化钠固体配制100 mL 1.0mol·L-1氢氧化钠溶液时,需要用到的玻璃仪器有玻璃棒、胶头滴管、烧杯、量筒和 ________________________________。
(2)配制一定物质的量浓度溶液时用到的仪器较多,下列有关叙述正确的是_____。
a.称量NaOH固体时,分别在天平的两个托盘垫上相同大小的纸片
b.玻璃棒的作用是搅拌、引流
c.用浓硫酸配制稀溶液时,在量筒中稀释后要冷却至室温再转移到容量瓶中
d.容量瓶在使用前要检查是否漏水
(3)实验室配制一定物质的量浓度硫酸溶液,在用量筒量取浓硫酸时俯视读数,结果配制出的硫酸溶液浓度将会________。(填偏大、偏小或无影响)
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Fe3+、SO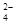 、NO
、NO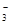 、CO
、CO 、Cl
、Cl 。某同学收集了该地区的雾霾,经必要的预处理后获得试样溶液,设计并完成了如下的实验:
。某同学收集了该地区的雾霾,经必要的预处理后获得试样溶液,设计并完成了如下的实验: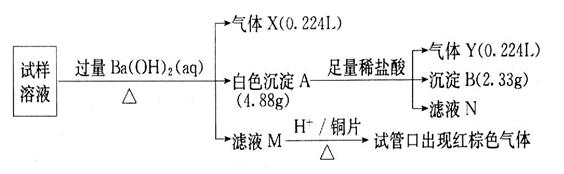
回答下列问题:(注明:白色沉淀A4.88g改为4.30g)
(1)检验气体X通常使用的试剂是______________________;
(2)沉淀B是_________,在沉淀A中加入足量稀盐酸后,溶解的沉淀是_________;
(3)试样中肯定不存在的离子是___________,不能确定是否存在的离子是______;
(4)滤液M在酸性条件下与铜片的反应中,还原产物是________________________。
(5)将实验中得到的气体Y全部通入10mL1.2mol·L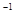 的氢氧化钠溶液中,所得溶液中含有阴离子主要有________________________________________。
的氢氧化钠溶液中,所得溶液中含有阴离子主要有________________________________________。
铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,同答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是________。(填序号)
a.纯铁硬度比生铁高
b.纯铁耐腐蚀性强,不易生锈
c.不锈钢是铁合金,只含金属元素
d.铁在一定条件下,可与水蒸气反应
e.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1mol L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为_____________,所形成该分散系的微粒范围是__________。
L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为_____________,所形成该分散系的微粒范围是__________。
(3)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路极。请写出FeCl3溶液与铜反应的离子方程式___________。
(4)高铁酸钠(Na2FeO4)是一种新型净水剂。
①高铁酸钠在水中可以发生如下反应:4FeO4 +10H2O=4Fe(OH)3+8OH
+10H2O=4Fe(OH)3+8OH +3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________。
+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________。
②下列物质能用作净水剂的有___________。
a.KAl(SO4)2 l2H2O b.聚合硫酸铁
l2H2O b.聚合硫酸铁
c.ClO2 d.“84”消毒液