工业上制取硝酸铵的流程图如图1,请回答下列问题:

(1)在上述工业制硝酸的生产中,B设备的名称是 ,其中发生反应的化学方程式为 。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是 。
1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程。示意图如图2: 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
氨气还原法:8NH3+6NO2 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是 。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表。
注意事项 理由
①
②
按要求回答下列问题:
(1) 用电子式表示H2O的形成过程________________________。
(2) 用电子式表示MgCl2的形成过程________________________。
(1)有机物若完全燃烧生成CO2和H2O,或不完全燃烧生成CO、CO2、H2O。则此有机物含有元素的组成情况(填元素符号)。
(2)某有机物ag与0.8mol O2在密闭容器中充分混合后点燃。待充分反应后,将产物中的H2O(g)和其它气态产物先缓慢通过足量澄清石灰水,产生40g白色沉淀,溶液质量减少0.8g。余下气体通过浓硫酸干燥后,再缓慢通过足量灼热CuO,固体由黑变红。将产生的气体又缓慢通过足量过氧化钠,充分反应后固体质量增加11.2g且只有氧气放出(假设每一步都充分反应或吸收)。请回答下列问题:
①通过计算确定该有机物化学式为。
②若ag该有机物恰好与18.4g金属钠完全反应,试确定该有机物的结构简式。
③若0.4mol该有机物恰好与9.2g金属钠完全反应,试确定该有机物的结构简式。
(已知① 醚不与钠反应 ②一个碳原子上同时连2个或多个羟基是不稳定的)
工业上用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其生产流程如下图所示。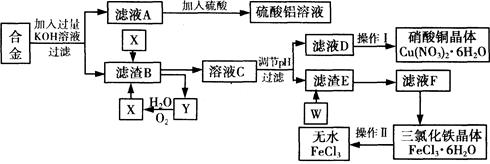
已知:调节适当PH范围可使Fe3+沉淀完全而Cu2+不会沉淀。
请回答下列问题:
(1)写出向合金中加入KOH溶液后所发生反应的离子方程式:。
(2)在滤液A中直接加入硫酸后所得到的硫酸铝溶液中除含少量硫酸外,还一定含有的杂质是
(填化学式)。
请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液,仿照上图形式画出制备流程图(提示:在箭头上下方标出所用试剂和实验操作)。
(3) 写出试剂X的名称。
(4) 实验操作I的顺序依次为 (选填序号)。
| A.蒸馏 | B.蒸发浓缩 | C.过滤 | D.冷却结晶 |
(5) 要制得更纯的Cu(NO3)2·6H2O晶体,必须进行的操作是 (填操作名称)
(6)写出滤渣E与W反应的化学方程式:。
烃X产量是衡量一个国家石油化工水平高低的标志,A、E均为X的同系物。
已知:①
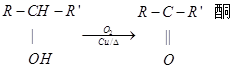
 (酮中R、R’代表烃基且酮不能再被氧化为羧酸,其它物质中R、R’代表烃基或氢原子)
(酮中R、R’代表烃基且酮不能再被氧化为羧酸,其它物质中R、R’代表烃基或氢原子)
②低级酯通常具有水果香味
上述图解中E为直链结构,F只能被氧化为酮。则
(1)X官能团结构式为, A→B反应类型。
(2)E可能的结构简式为;B、G中官能团名称分别是。
(3)A所形成的高分子化合物是常用食品包装袋的原材料,写出此高聚物的结构简式。
(4)写出D与F反应生成G的化学方程式。
(5)符合以下条件的G的同分异构体共有种(不包括G)。(①具有水果香味②酸性条件下水解产物等相对分子质量)
X、Y、Z、W、Q五种前四周期元素,原子序数依次增大。已知五种元素中只有一种为金属元素, XW2是通常呈液态的有机物,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为1,次外层电子数等于Y和W2 - 最外层电子数之和。根据以上信息回答下列问题:(用元素符号或化学式等化学用语回答)
(1)XW2的电子式为。
(2)Y原子中电子运动状态有种, Z的气态氢化物在同主族元素气态氢化物中最高是因为。
(3)Q在周期表中的位置,其基态原子简化电子排布式为。交警可以用H2SO4酸化的K2 Cr2O7溶液检测驾驶员是否酒驾,其产物为乙酸、Q3+等。
请写出此原理的离子方程式。
(4)含W的两种元素种类相同的酸式铵盐溶液反应的离子方程式
。
(5)某种燃料电池一极通乙醇的最简单同系物蒸气,一极通Z2,以NaOH溶液为电解液。请写出该原电池负极的电极反应式。