有关元素的部分信息如下表所示:
| 元素 |
A |
B |
R |
D |
| 相应信息 |
短周期元素、最高正价为+7 |
基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子 |
R核外电子共有15种运动状态 |
D与A能形成两种常见的化合物DA2,DA3 |
回答下列问题:
(1)D的基态原子电子排布式为 ,A、B、D三种元素电负性由大到小的顺序为 (用具体的元素符号填写)。
(2)化合物BA4、RA3、RA5中,中心原子的轨道类型不是sp3杂化的是 ,分子构型是正四面体的是 ,属于极性分子的是 (用化学式填写)。
(3)已知DA3的沸点:319℃,熔点:306℃,则DA3的晶体类型为 ,B与氢元素能形成BnH2n+2(n为正整数)的一系列物质,这一系列物质沸点的变化规律是 。
(4)R可形成H3RO4、HRO3、H3RO3等多种酸,则这三种酸酸性由强到弱的顺序为 (用化学式填写)。
(5)已知D的单质有如图所示的两种常见堆积方式:其中属于面心立方最密堆积的是 (填a或b);若单质D按b方式紧密堆积,原子半径为r cm,NA表示阿伏加德罗常数的值,则单质D的密度 g/cm3(列出算式即可)。

V、W、X、Y、Z五种短周期元素的原子序数依次增大,在周期表中W与V、X相邻,Y与Z相邻,X、Y同主族。Z的化合物可以发生某一反应,其离子方程式为: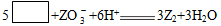 (未完成)。
(未完成)。
(1)Y、Z两种元素的简单离子的半径大小关系为 (用离子符号表示)。
(2)五种元素中分子的空间构型相同的氢化物沸点高低排列顺序为
(用分子式表示),其原因是 。
(3)V与Z单质不能直接化合生成VZ4,在催化剂作用下由VY2与Z2反应制得VZ4,其化学反应方程式为VY2+Z2→VZ4+Y2Z2(未配平)。
①写出上述化学反应方程式 。
②Y2Z2分子中,Y与Z均满足8e-结构,则Y2Z2的结构式为 。
③Y与W两种元素形成一种重要化合物A,A分子的结构如图所示: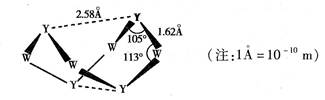
6mol Y2Z2与16mol W的简单氢化物恰好完全反应生成A、Y单质和一种中学化学中常见的盐。写出该反应的化学方程式: 。
A是常见的有机物,现有如下反应关系: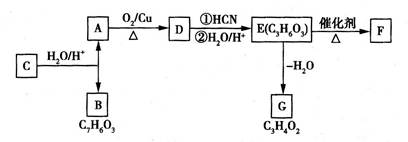
已知:①醛可以发生如下反应: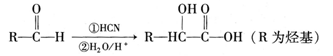
②B与乙酸酐(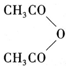 )能发生取代反应生成阿司匹林(
)能发生取代反应生成阿司匹林(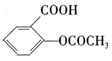 )
)
③F为一种可降解的高分子聚合物
④G在一定条件下可生成(C3H4O2)n
(1)由A生成D的化学方程式是 。
(2)B分子中的含氧官能团是 (写名称)。
(3)G的结构简式是 。
(4)由E生成F的化学方程式是 。
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO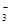 +4H++3e-→NO+2H2O
+4H++3e-→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)物质甲为 ,在该反应中作 剂。
(2)写出并配平该氧化还原反应的离子方程式: 。
(3)反应中若转移电子0.6mol,则产生气体在标准状况下的体积为 。
(4)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O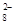 +2I-=2SO
+2I-=2SO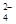 +I2
+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程: 、 。
某溶液由盐酸、Na2CO3、H2SO4、CuCl2四种物质中的一种或几种混合形成,现向该混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示。
(1)该溶液中一定含 。(填化学式)
(2)写出图中a点之前的离子方程式: ;
写出图中a→b点的离子方程式: 。
(3)将所得沉淀进行过滤,洗涤,干燥,称量,应如何判断沉淀是否完全洗净:
。
(4)若b点时沉淀质量=2.94克,V1=20mL,V2=40mL,求C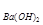 = 。
= 。
(1)若a克某气体中含有的分子数为b,则c克该气体在标准状况下的体积是(用NA表示阿伏加德罗常数)
(2)若同温同压下,m克A气体与n克B气体的分子数相同,则气体A与B在标况下的密度之比为 ,同质量的气体A与B的分子数之比为 。
(3)若以24克12C中所含的碳原子数为阿伏加德罗常数,则下列数值如何变化:(填“增大”、“减小”或“不变”)
O2的摩尔体积 ;O2的摩尔质量 ;同温同压下,一定质量O2的体积 ;同温同压下,一定体积O2的分子个数 。