下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+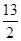 O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
②C4H10(g)+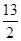 O2(g)===4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
O2(g)===4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
③C4H10(g)+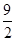 O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
④C4H10(g)+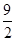 O2(g)===4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
O2(g)===4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
由此判断,正丁烷的燃烧热是 ( )
| A.ΔH=-2 878 kJ·mol-1 | B.ΔH=-2 658 kJ·mol-1 |
| C.ΔH=-1 746 kJ·mol-1 | D.ΔH=-1 526 kJ·mol-1 |
下列说法正确的是①NaCl晶体中每个Na+同时吸引着8个Cl-,CsCl晶体中每个Cl-同时吸引着6个Cs+ ②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质③水分子之间存在氢键,所以水受热不易分解④胶体的本质特征是丁达尔现象⑤除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤⑥可用Ba(OH)2溶液同时鉴别Fe(NO3)3、AlCl3、NH4Cl、FeCl2、Na2SO4五种溶液
| A.②⑤⑥ | B.①②④ | C.②④⑤ | D.③⑤⑥ |
现有A、B两种链状饱和一元醇的混合物0.3 mol,其质量为13.8g。已知A和B分子中碳原子数均不大于4,且A发子中的碳原子数小于B。则下列说法正确的是
A.B的分子式是CH4O
B.若n(A)=n(B),A、B分子组合只有1种情况
C.若n(A)≠n(B),A、B分子组合有4种情况
D.n(A)∶n(B)=1∶1或2∶1
下列溶液中有关物质的量浓度关系正确的是
A.0.2 mol/L 的NaHCO3溶液: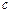 (HCO3_)> (HCO3_)>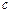 (CO32-)>0.1 mol/L > (CO32-)>0.1 mol/L >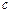 (H2CO3) (H2CO3) |
B.pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合: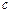 (Na+)> (Na+)>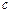 (CH3COO-)> (CH3COO-)>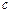 (OH-)> (OH-)>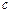 (H+) (H+) |
C.0.2 mol/L CH3COOH溶液和0.2 mol/L CH3COONa溶液等体积混合: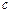 (CH3COO-)+ (CH3COO-)+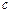 (OH-)- (OH-)-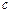 (H+)=0.1 mol/L (H+)=0.1 mol/L |
| D.0.1 mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合: |
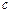 (CO32-)+2
(CO32-)+2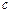 (OH-)=
(OH-)=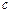 (HCO3_)+3
(HCO3_)+3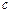 (H2CO3)+2
(H2CO3)+2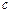 (H+)
(H+)
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应 A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率时间变化的如下图所示。下列说法正确的是
A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率时间变化的如下图所示。下列说法正确的是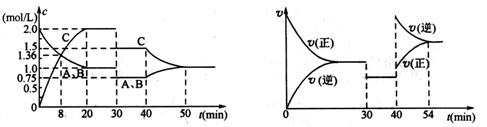
| A.8min前A的平均反应速率为0.08 mol ·L-1·min-1 |
| B.20min~40min间该反应的平衡常数为5 |
| C.30min时改变的条件是降低温度,40min时改变的条件是升高温度 |
| D.反应方程式中的x=1,且正反应为放热反应 |
某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①pH试纸检验,溶液的pH>7。②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液。④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤。⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。则关于原溶液的判断中不正确的是
| A.肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- |
| B.肯定存在的离子是Na+、K+、SO32-、Br- |
| C.无法确定原溶液中是否存在Cl- |
| D.若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断有影响 |