关于1 mol H2O的叙述正确的是
| A.含有1 mol 氢气 |
| B.质量为18 g/mol |
| C.在标准状况下的体积为22.4 L |
| D.含有水分子的个数约为6.02×1023 |
足量的镁与一定质量的盐酸反应,由于反应速率太快,若要减慢反应速率,但不能影响产生氢气的总质量,可以加入的物质是
| A.CuSO4 | B.NaOH | C.K2CO3 | D.CH3COONa |
下列各装置中都盛有0.1 mol·Lˉ1的NaCl溶液,放置一定时间后,锌片的腐蚀速率由快到慢的顺序是 
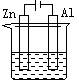
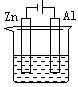
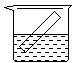
① ②③ ④
| A.③①④② | B.①②④③ | C.①②③④ | D.②①④③ |
用铂作电极电解1L含有0.4molCuSO4和0.2molNaCl的水溶液,一段时间后在一个电极上得到了19.2 g Cu,在另一极上析出的气体在标况下的体积是
| A.4.48 L | B.5.6 L | C.6.72 L | D.13.44 L |
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为:
Zn + 2 MnO2 + H2O ="=" ZnO + 2MnO (OH)。下列说法正确的是
| A.该电池的正极为锌 |
| B.该电池反应中二氧化锰起催化剂作用 |
| C.当 0.l mol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023 |
| D.电池正极反应式为: 2MnO2 + 2e -+2H2O ="=2MnO" (OH)+2OH- |
用惰性电极电解下列各稀溶液,经一段时间后,溶液的pH值保持不变的是
| A.AgNO3溶液 | B.NaCl溶液 | C.H2SO4溶液 | D.K2SO4溶液 |