(10分)
(1)常温下,0.1 mol/L的甲酸和0.1 mol/L的盐酸各100 mL,分别与足量的同浓度氢氧化钾溶液反应所需氢氧化钾溶液的体积前者__________后者(选填“>”、“<”或“=”)。
(2)常温下,0.1 mol/L的甲酸和pH=1的甲酸各100 mL,分别与足量的碳酸氢钠溶液反应,产生的气体前者比后者__________(选填“多”、“少”或“=”)。
(3)在25 ℃条件下,将pH=10的偏铝酸钠溶液稀释100倍,稀释后溶液的pH为(填选项字母,下同)__ ___。
A.10 B.8 C.10~12之间 D.8~10之间
(4) 25 ℃时,向0.1 mol/L的甲酸溶液中加入少量甲酸钠晶体,当晶体溶解后测得溶液pH将____。
A.增大 B.减小 C.不变 D.无法确定
(5) 室温下,向0.1 mol/L的H2SO4中加入足量的锌粒,若想减慢H2产生的速率,但又不影响H2的体积,可以向硫酸溶液中加入__________试剂。
A.硫化钠晶体 B.甲酸钠晶体 C.少量银粉 D.硫酸钠溶液
以下是25℃时几种难溶电解质的溶解度:
| 难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子.例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反 应,过滤结晶即可;
应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为____________(填化学式)而除去.
(2)①中加入的试剂应该选择________为宜,其原因是__________________.
(3)②中除去Fe3+所发生的总反应的离子方程式为_____________________.
(4)下列与方案③相关的叙述中,正确的是________(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
分析、归纳、探究是学习化学的重要方法和手段之一.下面就电解质A回答有关问题(假定以下都是室温时的溶液).
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a.
①试说明HnB的酸性强弱_______________________________________.
②当a=10时,A溶液呈碱性的原因是(用离子方式程式表示)________________.
③当a=10、n=1时,A溶液中各种离子浓度由大到小的顺序为
_______________________________________________________.
c(OH-)-c(HB)=________.
④当n=1、c=0.1、溶液中c(HB)∶c(B-)=1∶99时,A溶液的pH为__________(保留整数值).
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρ g/cm3,Xm+离子的浓度为c mol/L,则该难溶物XnYm的溶度积常数为Ksp=__________________________,该温度下XnYm的溶解度S=____________.
某温度(t℃)时,测得0.01 mol/L的NaOH溶液的pH为11,则该温度下水的Kw=________,该温度________25℃(填“大于”“小于”或“等于”),其理由是________________________________________________________________________
此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得溶液为中性,且a=12,b=2,则Va∶Vb=____________;
(2)若所得溶液为中性,且a+b=12,则Va∶Vb=________;
(3)若所得溶液的pH=10,且a=12,b=2,则Va∶Vb=______________.
研究NO2、SO2 、CO等大气污染气体的处理方法具有重要的意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=kJ·mol-1。
SO3(g)+NO(g)的ΔH=kJ·mol-1。
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
若测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=。
水的电离平衡曲线如下图所示。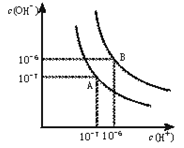
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,Ca(OH)2的离子积为。
(4))25℃时,在等体积的① pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是