下列实验能获得成功的是( )
| A.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯; |
| B.用溴水可鉴别苯、CCl4、苯乙烯 |
| C.鉴定溴乙烷中存在溴元素的实验操作是先加入NaOH溶液,加热后再加入AgNO3溶液 |
| D.配制银氨溶液时,将硝酸银溶液逐滴加入到稀氨水中 |
在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B(g)  3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是
3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是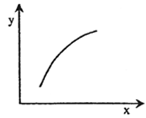
| 选项 |
x |
y |
| A |
降温 |
A的体积分数 |
| B |
升高温度 |
混合气体的密度 |
| C |
再加入A |
B的转化率 |
| D |
再加入C |
A的体积分数 |
将6molA和2molB在2L的密闭容器中混合并在一定条件下发生如下反应:3A(g)+B(S) 2C(g) ΔH<0,4s(秒)后反应达到平衡状态,此时测得C的浓度为1mol·L-1,下列说法中正确的是
2C(g) ΔH<0,4s(秒)后反应达到平衡状态,此时测得C的浓度为1mol·L-1,下列说法中正确的是
A.4s内用物质B表示的反应速率为0.125mol·L-1·S-1
B.达到平衡后若向容器中通入惰性气体,则A的转化率增大
C.此时,A、B、C的物质的量之比为3:1:2
D.达平衡后若升高温度,C的浓度将增大
两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是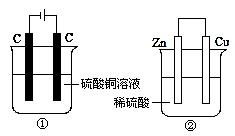
| A.产生气体体积 ①=② |
| B.①中阴极质量增加,②中正极质量减小 |
| C.电极反应式:①中阳极:4OH- - 4e- →2H2O+O2↑②中负极:2H++2e-→H2↑ |
| D.溶液的pH变化:①减小,②增大 |
下列变化过程放热的是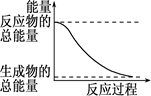
| A.H2O(l)→H2O(g) |
| B.2HI(g)→H2(g)+I2(g)+QQ=—14.9 kJ/mol |
| C.形成化学键时共放出能量862 kJ的化学反应 |
| D.能量变化如上图所示的化学反应 |
黄铜矿(CuFeS2)常用于提炼金属铜。黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为2CuFeS2+O2===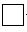 +2FeS+SO2(已配平),则下列关于该反应的说法错误的是
+2FeS+SO2(已配平),则下列关于该反应的说法错误的是
| A.方框中的物质应为Cu2S |
| B.该反应的部分产物可用于硫酸工业 |
| C.反应中SO2既是氧化产物又是还原产物 |
| D.反应中若有1 mol SO2生成,则一定有4 mol电子发生转移 |