下图是C60的分子模型、金刚石和干冰的晶体模型。请回答下列问题: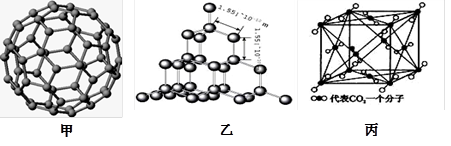
(1)硅与碳同主族,写出基态硅原子的价电子排布图______________。
(2)上述三种物质的熔点由高到低的顺序是 ,理由是 。
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目是_________,1mol二氧化硅晶体中Si—O键的数目为 。
(4)图丙是干冰的晶胞模型,1个CO2分子周围距离最近的CO2分子有 个。
如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是()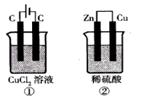
| A.产生气体的体积:①>② |
| B.溶液的pH变化:①增大 ②不变 |
| C.电极上析出物质的质量:①>② |
D.电极反应式:①中阳极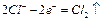 ②中负极 ②中负极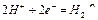 |
下面有关丙烷、丙烯、丙炔说法中正确的有()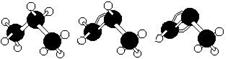
| A.丙烷、丙烯、丙炔的结构简式分别为 |
| B.相同物质的量的三种物质完全燃烧后,在标准状况下,生成的气体体积比7:6:5 |
| C.丙烷、丙烯、丙炔三种物质的熔沸点逐渐升高 |
| D.丙烷、丙烯、丙炔三种物质分子中所有的碳原子都处在同一平面 |
根据图中包含的信息分析,下列叙述正确的是()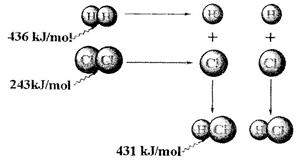
A.氢气与氯气反应生成1mol氯化氢气体,反应的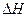 =+248kJ/mol =+248kJ/mol |
| B.436 kJ/mol是指断开1 mol H2中的H-H键需要放出436 kJ的能量 |
C.氢气与氯气反应生成2mol氯化氢气体,反应的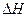 =-183kJ/mol =-183kJ/mol |
D.该反应的热化学方程式是H2(g)+Cl2(g)="=2HCl(g)" 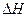 =+183kJ/mol =+183kJ/mol |
在2 L密闭容器中,发生3A(g)+B(g)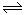 2C(g)的反应,若最初加入A和B都是4 mol,A的平均反应速率为0.12 mol·L-1·s-1,则10 s后容器中B的物质的量浓度是()
2C(g)的反应,若最初加入A和B都是4 mol,A的平均反应速率为0.12 mol·L-1·s-1,则10 s后容器中B的物质的量浓度是()
| A.1.4 mol·L-1 | B.1.6 mol·L-1 |
| C.1.8 mol·L-1 | D.3.2 mol·L-1 |
下列叙述正确的是()
| A.液晶是由分子较大、分子形状呈长形或碟形的物质形成的晶体 |
| B.制造光导纤维的主要材料是高纯度硅,属于原子晶体 |
| C.H2O分子比H2S分子稳定是因为水分子之间存在氢键 |
| D.NaCl和MgO晶体熔融时克服的作用力相同 |