在密闭容器中进行X2(g)+4Y2(g)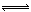 2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是 ( )
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是 ( )
| A.c(X2)="0.15" mol·L-1 | B.c(Y2)="0.9" mol·L-1 |
| C.c(Z2)="0.3" mol·L-1 | D.c(Q2)="0.5" mol·L-1 |
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列叙述正确的是
| A.铜电极上发生氧化反应 |
| B.电池工作一段时间后,甲池的c(SO42-)减小 |
| C.电池工作一段时间后,乙池溶液的总质量增加 |
| D.阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是
| A.负极反应式: Ag+Cl-e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na2Mn5O10是还原产物 |
| D.Cl-不断向电池的正极移动 |
大功率Al H2O2动力电池原理如图所示,下列说法不正确的是

| A.电池组成中Al电极是负极 |
| B.OH-从碳纤维电极透过离子交换膜移向Al电极 |
| C.碳纤维电极的电极反应是H2O2+2e-+2H+=2H2O |
| D.该电池反应的离子方程式是2Al+3H2O2+2OH-=2Al(OH)4- |
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2。下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
| D.电池充电过程中,阴极附近溶液的pH降低 |
已知Ksp (AgCl)=1.8×10-10,Ksp(AgI)=1.0 ×10-16。下列关于难溶物之间转化的说法中错误的是
| A.AgCl难溶于水,不能转化为AgI |
| B.同一类型难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质 |
| C.常温条件下,将饱和的AgCl溶液和AgI溶液等体积混合,会有沉淀生成 |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须大于(1/ )×10-11mol/L )×10-11mol/L |