利用反应:Cu2Cl2+C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔。
(1)基态时亚铜离子核外电子排布式为 。
(2)NH3中氮原子的杂化方式为 ;NH4+空间构型为 (用文字描述)。
(3)乙炔分子中σ键与π键数目之比为 ,与C22-互为等电子体的分子有 (写化学式,举一例)。
(4)氯化亚铜晶胞结构如下图,晶胞中含Cu+数目为 。
(5)合成氨工业常用铜(I)氨溶液吸收CO生成[Cu(NH3)3(CO)]+,该配离子中配体有 (写化学式)。
某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO-+ Cl-+ 2H+ = Cl2↑+ H2O。某学习小组拟探究该消毒液的变质情况。
(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过下列装置检验气体的成分可以判断消毒液是否变质。
学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙:。
为了验证可能为甲,请完成下列实验方案。限选试剂:
①98%的浓硫酸②1%的品红溶液③1.0 mol·L-1的KI-淀粉溶液④1.0 mol·L-1 的NaOH溶液⑤澄清石灰水⑥饱和NaCl溶液
| 所加试剂 |
预期现象和结论 |
| 试管A中加足量(填序号); 试管B中加1%品红溶液; 试管C中加(填序号)。 |
若___ ___, 则甲成立。 |
(2)用滴定法测定消毒液中NaClO的浓度(滴定过程涉及的反应有:NaClO + Na2SO3 = NaCl+ Na2SO4 ;2KMnO4 + 5Na2SO3+ 3H2SO4 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O)。实验步骤如下:
①量取25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液v1 mL;
②在使用滴定管之前首先进行的操作是____;将b mol·L-1的酸性KMnO4溶液装入中;滴定,KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不褪时,停止滴定,记录数据。
③重复滴定操作2次,平均消耗酸性KMnO4溶液v2 mL。则消毒液中NaClO的浓度为mol·L-1(用含a、b、v1、v2的代数式表示)。
(l)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点金属。
已知:4Al(s)+3O2(g)=2Al2O3(s) 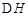 =-2830kJ·mol-1
=-2830kJ·mol-1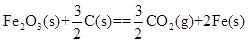
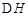 =+230kJ·mol-1
=+230kJ·mol-1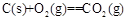
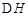 =-390kJ·mol-1
=-390kJ·mol-1
铝与氧化铁发生铝热反应的热化学方程式是。
(2)如下图所示,各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是;
②装置中Cu电极上的电极反应式为。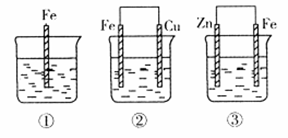
(3)钒(V)及其化合物广泛应用于新能源领域。全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。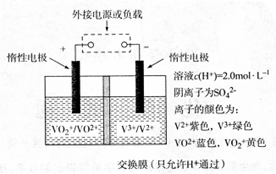
①当左槽溶液逐渐由黄变蓝,其电极反应式为。
②充电过程中,右槽溶液颜色逐渐由色变为色。
硼元素B在化学中有很重要的地位。硼的化合物在农业、医药、玻璃等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式_________________。从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为___________。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是_____________________________。
(3)在BF3分子中中心原子的杂化轨道类型是__________,SiF4微粒的空间构型是__________。又知若有d轨道参与杂化,能大大提高中心原子成键能力。试解释为什么BF3、SiF4水解的产物中,除了相应的酸外,前者生成BF4一后者却是生成SiF62—:______________________________________________。
(4)科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。下图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为_______。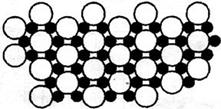
利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为________。
(二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):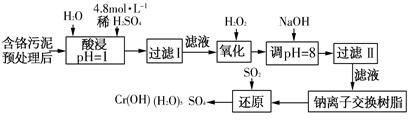
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
| 开始沉淀 时的pH |
1.9 |
7.0 |
— |
— |
4.7 |
— |
| 沉淀完全 时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是________(至少写一条)。
(2)调pH=8是为了除去________(填Fe3+、Al3+、Ca2+、Mg2+)。
(3)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是________(填Fe3+、Al3+、Ca2+、Mg2+)。
(4)试配平氧化还原反应方程式:□Na2Cr2O7+□SO2+□H2O = □Cr(OH)(H2O)5SO4+□Na2SO4;每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为________。
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合浊液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:①________;②________;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。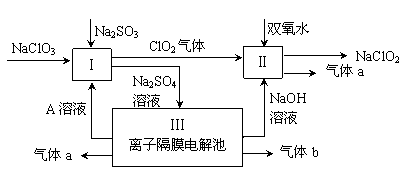
(1)双氧水的结构式为:;Ⅰ中发生反应的还原剂是 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式 。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填相同、不相同或无法判断)