酸碱质子理论认为,凡是能给出质子(H+)的都是酸,凡能结合质子的都是碱,依据酸碱质子理论属于酸碱两性物质的是
| A.HCl | B.NaOH |
| C.Fe2O3 | D.NaHCO3 |
有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列事实不能说明上述观点的是
| A.苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 |
B.乙烯能发生加成反应,乙 烷不能发生加成反应 烷不能发生加成反应 |
| C.甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 |
| D.苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |
下列对有机物结构或性质的描述,错误的是
| A.苯酚钠溶液中通入CO2生成苯酚,则碳酸的酸性比苯酚弱 |
| B.一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
C.乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2 O O |
D.硬 脂酸甘油酯的皂化反应的两种产物均可溶于水 脂酸甘油酯的皂化反应的两种产物均可溶于水 |
用括号内试剂除去下列各物质中的少量杂质,正确的是
| A.溴苯中的溴(KI溶液) | B.溴乙烷中的乙醇(水) |
| C.乙酸乙酯中的乙酸(饱和Na2CO3溶液) | D.硬脂酸中的油酸(Br2水) |
下列说法中正确的是
| A.常温下,淀粉遇I- 变蓝色 | B.油脂、淀粉、纤维素都是高分子化合物 |
| C.所有烷烃和糖中都存在碳碳单键 | D.油脂水解可得到高级脂肪酸和甘油 |
下列说法或表示方法正确的是
| A.乙烯的结构简式CH2CH2 | B.化学名词:乙酸乙脂、笨、油酯、坩埚 |
C.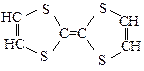 是一种烃 是一种烃 |
D.乙醚的分子式为C4H10O |