下列离子方程式书写正确的是( )
| A.少量CO2通入Ba(OH)2溶液中:CO2+2OH—= CO32— +H2O |
| B.NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42—恰好沉淀完全 NH4++Al3++2SO42—+2Ba2++4OH—= NH3·H2O+Al(OH)3↓+2BaSO4↓ |
| C.FeCl3溶液腐蚀铜线路板:Fe3++Cu = Fe2++Cu2+ |
| D.向NaHCO3溶液中滴入少量Ca(OH)2溶液:HCO3—+OH—= CO32—+H2O |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X 与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g· L -1,W在短周期主族元素中原子半径最大。下列说法正确的是
| A.原子半径:W> Y> X |
| B.元素X与M形成化合物的空间构型可以是正四面体型、直线型或平面型等 |
| C.将X Z2通入W单质与水反应后的溶液中,生成的盐一定只有一种 |
| D.Y元素的含氧酸都属于强酸 |
著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
| A.铈(Ce)元素在自然界中主要以单质形式存在 |
| B.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑ |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+ = Ce3++2Fe3+ |
D.四种稳定的核素 、 、 、 、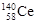 、 、 ,它们互称为同位素 ,它们互称为同位素 |
氧族元素包括氧、硫、硒、碲、钋等,右图为氧族元素氢化物a、b、c、d的生成热数据示意图,下列关于氧族元素的说明正确的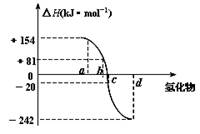
| A.含有18e-的两种氢化物中只存在极性键 |
| B.氢化物的沸点大小是H2O<H2S<H2Se<H2Te |
| C.a所对应的氢化物是H2O |
| D.每1mol H2S分解会吸收20KJ的热量 |
下列各组中的反应,属于同一反应类型的是( )
| A.乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷 |
| B.乙醇和氧气制乙醛;葡萄糖与新制的氢氧化铜共热 |
| C.蔗糖与稀硫酸共热;苯和氢气制环己烷 |
| D.乙醇制乙烯;苯的硝化反应 |
下列离子方程式书写不正确的是
| A.NaOH溶液与SO2反应,当n(NaOH)∶n(SO2)=4∶3时:4OH- + 3SO2 = SO32-+ 2HSO3-+ H2O |
| B.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH- |
| C.AgNO3溶液中加入过量的氨水:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O |
| D.1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |