某溶液中含有大量NH4+、Na+、HCO3ˉ、CO32ˉ、CH3COO-,加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)
| A.Na+ | B.CO32ˉ |
| C.CH3COO- | D.NH4+ |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.10g46%的乙醇溶液所含氢原子数为1.2 NA |
| B.0.5 mol熔融的NaHSO4中含有的离子数目为1.5NA |
| C.标准状况下,2.24 L甲醇中含有C—H键的数目为0.3NA |
| D.S2和S8的混合物共38.4 g,其中所含硫原子数为1.4NA |
下列说法正确的是
| A.能自发进行的化学反应,一定是△H<0、△S>0 |
| B.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| C.焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化 |
| D.钢铁发生电化学腐蚀时,负极的电极反应式为 Fe–3e- = Fe3+ |
下列有关物质的分类合理的是
| A.C60、HD均属于单质 | B.漂白粉、明矾均属于混合物 |
| C.氯化铵、硫酸均属于离子化合物 | D.SO2、NxOy均属于酸性氧化物 |
下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是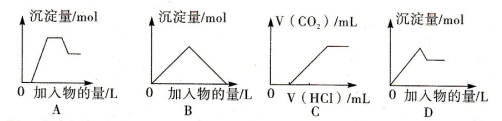
| A.图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线 |
| B.图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 |
| C.图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 |
| D.图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线 |