目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
提示: ①MgCl2晶体的化学式为MgCl2•6H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)操作①的名称是 , 操作②的名称 、 、过滤。
(2)试剂a的名称是 。
(3)用氯化镁电解生产金属镁的化学方程式为: 。
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是 。
实验室用密度为1.18g·mL-1,质量分数为36.5%浓盐酸配制250mL0.1mol·L-1的盐酸溶液,填空并请回答下列问题:(1)配制250mL0.1mol·L-1的盐酸溶液
| 应称量盐酸体积/mL |
应选用容量 瓶的规格/mL |
除容量瓶外 还需要的其它仪器 |
(2)用量筒准确量取所需的浓盐酸的体积,用适量水在烧杯中稀释,等_______后,溶液注入容量瓶,这是为了防止所配溶液的浓度偏(填大或小),洗涤烧杯后,将洗涤液都移入容量瓶,其目的是;
(3)若出现如下情况,所配溶液的浓度偏高的是__________(填写字母).
| A.没有进行洗涤烧杯; | B.加蒸馏水时不慎超过了刻度; | C.若定容时俯视刻度线; | D.量取浓盐酸时仰视量筒;E、将量筒洗涤并将洗涤液转移到容量瓶中;F、转移溶液前容量瓶中有少量水。 |
某合金中铜和铁的物质的量均为0.3mol,将其全部投入b 4
4  的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。
的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。
(1)若金属有剩余,其质量为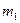 g,在溶液中再滴人稀硫酸后,剩余金属为
g,在溶液中再滴人稀硫酸后,剩余金属为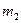 g,则
g,则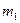 与
与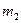 的关系为:
的关系为: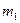
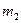 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)若b=450 ,则溶液中的金属阳离子为。
,则溶液中的金属阳离子为。
(3)若合金与硝酸溶液恰好反应完全,求b的取值范围(要有计算过程)
(9分)现有A、B、C三种均含同一种元素的无机物,它们之间的转化关系如下图所示(部分产物已略去):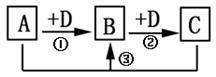
(1)若A、D为非金属单质:
①当M(A)>M(D)时,D为:;
②当M(D)>M( A)时,A为:;
A)时,A为:;
(2)若A为非金属单质,D为金属单质时,A为:;
(3)若D为非金属单质,A、B、C为卤化物时,写出①的化学反应方程式:。
(12分)下列是布洛芬(Ibuprofen)的两种绿色合成方案。
已知:RCH=CH2+CO+H2O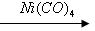 RCH(CH3)COOH
RCH(CH3)COOH
试回答下列问题:
(1)布洛芬的分子式为:。
(2)反应①、②分别所属的有机反应类型是:__________、__________。
(3)写出满足下列条件的D的所有同分异构体:(写结构简式)。
①苯环上有两个取代基处在对位 ②1mol该有机物质在一定条件下可最多消耗2molNaOH
③能与新制Cu(OH)2反应④该分子中存在4个甲基
(4)反应①的化学方程式为:_____ ____________________________________________。
____________________________________________。
(5)方案二经反应④一步合成布洛芬,原子利用率为100%,请写出此反应的化学方程式:________________________________________________________________________。
某校课外兴趣小组用如图装置进行电解CuC12溶液的实验。实验时 ,在通电一段时间后,观察到阳极上方的淀粉KI试纸不变色,同时,铁棒逐渐溶解;阴极碳棒上有红、白两种颜色的固体析出。同学们对阴、阳两极的产物进行如下探究:
,在通电一段时间后,观察到阳极上方的淀粉KI试纸不变色,同时,铁棒逐渐溶解;阴极碳棒上有红、白两种颜色的固体析出。同学们对阴、阳两极的产物进行如下探究: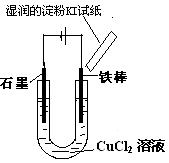
(1)阳极产物探究。
根据实验现象,同学们对阳极发生的电极反应提出了如下假设:
假设1;
假设2。
请你设计实验方案证明你的假设(包括:操作→现象→结论):。
(2)阴极产物探究:
| 查阅资料 |
铜和铜的化合物中Cu、Cu2O为红色,CuCl、CuBr、CuI为白色,它们在水中均不溶,且稳定存在。 |
| 探究实验 |
取出阴极碳棒,并将其干燥,然后用如图所示装置(气密性良好,药品性能良好)进行实验并记录现象: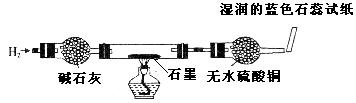 现象:碳棒上红色物质依然存在;白色物质变为红色;无水硫酸铜仍为白色;蓝色  石蕊试纸变为红色 石蕊试纸变为红色 |
结论与解释:
①白色物质为。
②某学生收集碳棒上的白色物质并装入试管中,滴人稀HNO3,写出白色物质与稀HNO3反应的离子方程式:。