乙二酸-1,4-环己二醇酯可以通过下列路线合成。请回答下列问题:
(1)上述反应①—④中,属于取代反应的有 (填序号);反应⑥—⑧中,属于加成反应的有 (填序号)。
(2)写出下列物质的结构简式:B ,C 。
(3)写出下列反应的方程式:
反应②: ; 反应⑦: 。
有机物A可以通过不同的反应得到下列物质:
B. C.
C. 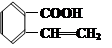
D.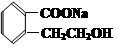 E.
E. 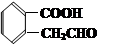
(1)A的结构简式是__________________
(2)写出由A制取B的化学方程式________________________
(3)写出A制取E这种物质的有机反应类型:______________; A与 __________(填写化学式)反应生成D。
(4)芳香族化合物F是A的同分异构体,1molF可以和3mol NaOH发生中和反应;F苯环上的一氯代物只有一种。写出F两种可能的结构简式 ______________________。
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。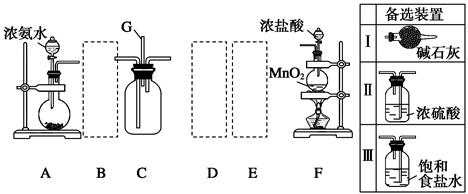
(1)装置F中发生反应的离子方程式:___________________。
(2)装置A中的烧瓶内固体可选用________(选填以下选项的代号)。
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B__________,D__________,E__________。(均填编号)
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,装置C内出现浓厚的白烟并在容器内壁凝结,请设计实验方案鉴定该固体就是氯化铵:____________________________。
(5)从装置C的出气管口处逸出的尾气可能含有污染环境的气体,如何处理?________________________________________________________________________________。
(1)已知20oC时的溶解度:Na2CO3:S=21.2g; NaHCO3:S=9.6g。则20oC恒温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出NaHCO3__________g(小数点后保留1位)
(2)向500mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。若通入CO2气体为2.24L(标准状况下),得到11.9g的白色固体。则所用的KOH溶液的物质的量浓度为______mol/L。
(3)将一定质量的钠加入到89g水中,完全反应后的溶液为100g,则该溶液的质量分数为________。
(4)现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液.现做如下实验:
①取440ml甲与120ml乙反应,产生1.56g沉淀;
②取440ml乙与120ml甲反应,也产生1.56g沉淀;
③取120ml甲溶液与400ml乙溶液反应,则产生3.12g沉淀;通过必要的计算和推理判定:
甲溶液为溶液,乙溶液为溶液。
(10分)已知A是治疗胃酸过多症的一种药剂,B是一种淡黄色固体,A、B以物质的量之比1∶1混合加热生成C、D、E三种物质,E、F、J是常见的气体单质,有如下转化关系: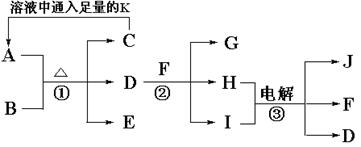
(1)写出A与D反应的离子方程式_________________________________________;
(2)写出反应②的化学方程式 __________________________________________。
(3)电解③时阳极产生气体168mL(标准状况),电解后溶液的体积为150mL,此时溶液的pH为________________。
(4)将等物质的量的A和C溶于100mL水中,下列溶液说法不正确的是_________。
A.2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3)
B.c(Na+)+ c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
C.c(CO32-)+2c(OH-)= 3c(H2CO3) + c(HCO3-) + 2c(H+)
D.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
(5)若A、B混合后加热得到纯净物,反应的方程式为_________________________
(4分)有一无色透明溶液,可能含Cu2+、NH、Al3+、Fe3+、Mg2+、Na+、K+、CO、SO、NO等离子中的若干种。现做如下实验:
①取少量该溶液,滴入用盐酸酸化的BaCl2溶液,有白色沉淀生成。
②另取部分溶液,加入过氧化钠,有无色气体放出,且有白色沉淀产生,加入过氧化钠的量与生成白色沉淀的量可用右图表示。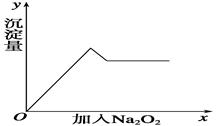
试推断:
(1)该溶液中一定存在__________________,一定不存在____________________,可能存在______________。
(2)上述溶液中至少有______________________等物质混合而成。