一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:
2X(g)+Y(g)  Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( )
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( )
| A.60 s内X的平均反应速率为0.001 mol·L-1·s-1 |
| B.将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的1/2 |
| C.若温度和体积不变,往容器内增加1 mol X,Y的转化率将增大 |
| D.若升高温度,X的体积分数增大,则正反应的△H>0 |
在无色透明强酸性溶液中,能大量共存的离子组是()
| A.K+、Cu2+、NO3-、SO42- | B.K+、Na+、Cl-、SO42- |
| C.Zn2+、NH4+、NO3-、Cl- | D.K+、Na+、MnO4-、CO32- |
下列离子方程式书写正确的是()
| A.氯气和水的反应: C12+H2O=2H++C1-+ClO- |
| B.稀硝酸与过量的铁屑反应: 3Fe+8H++2NO3- = 3Fe3++2NO↑+4H2O |
| C.铝跟氢氧化钠溶液反应:2Al + 2H2O + 2OH-=" 2" AlO2-+ 3H2↑ |
D.三氯化铁浓溶液滴入沸水中,制取氢氧化铁胶体: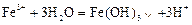 |
下列说法合理的是()
①KMnO4和H2S不能一起存放;②取用化学试剂不能用手直接去取;
③不能直接用鼻子闻SO2的气味;④点燃H2前要验纯;
⑤用蒸馏烧瓶加热液体要放碎瓷片;⑥有加热和洗气装置的实验要防止倒吸;
⑦稀释浓硫酸时要使水沿器壁慢慢流入硫酸中
| A.①②④⑤⑥ | B.①③④⑤⑥⑦ | C.①②③④⑤⑥ | D.②③④⑤⑥⑦ |
下列叙述正确的是()
| A.3Li+中含有的中子数与电子数之比为4∶3 |
| B.离子化合物中只含有离子键 |
| C.常温下,11.2L的甲烷气体中含有碳氢键的物质的量为2mol |
| D.常温下,可用铁制的容器来盛装浓硝酸或浓硫酸 |
中子数比质子数多1个的原子A,其阳离子An+ 核外有X个电子,则A的质量数为()
| A.2(x+n) | B.2(x-n)+1 | C.2(x +n)+1 | D.n+2 |