(1)下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是 :
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用时,常用0.5%的Na2SO4溶液解毒;③石灰岩(喀斯特地貌)的溶洞形成;④BaCO3不能做“钡餐”,而BaSO4则可以;⑤使用泡沫灭火器时“泡沫”生成的原理。
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |
(2)氯化铝水溶液呈 性 ,其离子方程式表示为 ;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
下列反应中氯元素全部被氧化的是____________,全部被还原的是____________,部分被氧化的是____________,既被氧化又被还原的是____________。
A.4HCl+MnO2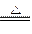 MnCl2+Cl2↑+H2O MnCl2+Cl2↑+H2O |
B.2NaCl 2Na+Cl2↑ 2Na+Cl2↑ |
| C.2KClO3====2KCl+3O2↑ | D.Cl2+H2O====HCl+HClO |
图所示的关系。
试回答下列问题:
(1)G的化学式为:。
(2)写出下列反应的化学方程式
①,
②。
(3)X在医药上用作解酸剂,与盐酸作用时,生成B的物质
的量与消耗盐酸的物质的量之比为3:8,则X的化学
式为:。
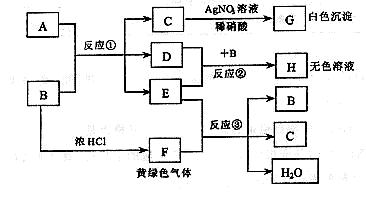
请回答:
(1) 依次写出A、B 中溶质的化学式:A_______ B________
(2) 依次写出反应①和②的离子方程式(H 中含有某+5价元素含氧酸根离子)
______________________________ ; ___________________________
(3) 写出反应③的化学方程式___________________________________

(1) ③号元素位于周期表第____周期第_____族,其单质的一种同素异形体能导电,该同素异形体的名称叫________
⑵④号元素形成的气态氢化物的电子式为__________,属于_____分子(填极性或非极性)
⑶⑥、⑦两种元素形成的最高价氧化物对应的水化物之间相互反应的离子方程式为_____________________________
⑷⑨号元素的原子结构示意图为_______________________。⑨与⑤两种元素形成的一种化合物是污染大气的主要有害物质之一,它对环境的危害主要是:
Ⅰ. 加入3mol SO2和2mol O2发生反应,达到平衡时放出的热量为 ____________
Ⅱ. 保持同一反应温度,在相同容器中,将起始物质的量改为 a mol SO2、 b mol O2 、c mol SO3 (g) ,欲使平衡时SO3的体积分数为2/9。
⑴达到平衡时,Ⅰ和Ⅱ放出的热量 ______(填序号)
A.—定相等 B.前者一定小 C. 前者大于或等于后者
(2) a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示)________________