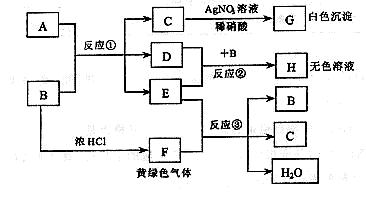
请回答:
(1) 依次写出A、B 中溶质的化学式:A_______ B________
(2) 依次写出反应①和②的离子方程式(H 中含有某+5价元素含氧酸根离子)
______________________________ ; ___________________________
(3) 写出反应③的化学方程式___________________________________
(共15分)已知A、B、C、D和E都是元素周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如图。 请回答:
请回答:
 (1)
(1) 写出B的电子排布图,C的元素符号是,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是;
写出B的电子排布图,C的元素符号是,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是;
(2) E属元素周期表中第周期,第族的元素,其元素名称是,它的+2价离子的电子排布式为:
E属元素周期表中第周期,第族的元素,其元素名称是,它的+2价离子的电子排布式为:
(3) 写出C的单质与水反应的化学方程式;
写出C的单质与水反应的化学方程式;
(4)如图所示,D跟B形成的离子化合物的化学式为;鉴别该离子化合物是否为晶体,最可靠的科学方法是,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相对原子质量分别为b、c,则晶胞的体积是cm3(只要求列出算式)。
(共14分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC形成的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为29。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)AC2在H2C(C的氢化物)中的溶解度不大,其主要原因是。
(2)B的氢化物的分子空间构型是。其中心原子采取杂化。
(3)写出化合物AC2的电子式;一种由B、C组成的化合物与AC2互为等电子体,其化学式为。
(4)向ESO4中逐滴加氨水至氨水过量,其现象为;产生此现象的原因(用离子方程式表示);。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是。
(共6分)以下物质①HF②H2③H2O④N2⑤C2H4⑥H2O2⑦NaCl(填序号)
(1)只含有极性键的是;
(2)既含有极性键又含有非极性键的是;
(3)属于极性分子的是;
(4)既有σ键又有π键的是;
(5)含有s—sσ键的是;
(6)以上物质为固体时,属于离子晶体的是。
某有机物的结构简式为HOOC—CH=CHCH2OH
(1)该有机物在一点条件下既能发生加聚反应又能发生缩聚反应,请分别写出产物的结构简式_______________;。
(2)验证该有机物中含有—COOH常采用的试剂是,产生的现象为。
(3)请从下列试剂中选择适当试剂,检验该有机物分子中含有醇羟基,并写出实验方法和现象
备选试剂:①钠②NaOH溶液③溴水④酸性KMnO4溶液⑤新制Cu(OH)2悬浊液
已知乙烯能发生以下转化: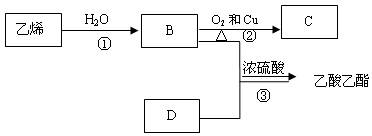
(1)工业制取乙烯的原料为
(2)写出B、D化合物中官能团:B中含官能团;D中含官能团;
(3)写出反应的化学方程式及反应类型
①反应类型
② 反应类型
③反应类型
(4)若工业上用空气代替氧气进行反应②,主要优点是_______,缺点是____。