下列说法正确的是
| A.CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构 |
| B.第ⅠA族的金属元素形成的单质的熔点随原子序数的递增而降低 |
| C.第ⅦA族元素形成的单质的熔点随原子序数的递增而降低 |
| D.第ⅠA族元素燃烧形成的氧化物中氧的化合价都不是-2 |
化学反应N2+3H2 2NH3的能量变化如下图所示,该反应的热化学方程式是
2NH3的能量变化如下图所示,该反应的热化学方程式是
A.N2(g)+3H2(g) 2NH3(1) △H=2(a-b-c)kJ·mol-1 2NH3(1) △H=2(a-b-c)kJ·mol-1 |
B.N2(g)+3H2(g) 2NH3(g) △H=2(b-a)kJ·mol-1 2NH3(g) △H=2(b-a)kJ·mol-1 |
C.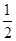 N2(g)+ N2(g)+ H2(g) H2(g)  NH3(1) △H=(b+c-a)kJ·mol-1 NH3(1) △H=(b+c-a)kJ·mol-1 |
D.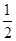 N2(g)+ N2(g)+ H2(g) H2(g) NH3(g) △H=(a+b)kJ·mol-1 NH3(g) △H=(a+b)kJ·mol-1 |
一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:2SO2+O2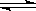 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
| A.2 mol SO2+ 1 mol O2 |
| B.4 mol SO2+ 1 mol O2 |
| C.2 mol SO2+ 1 mol O2+ 2mol SO3 |
| D.3 mol SO2+0.5mol O2+ 1molSO3 |
0.1mol·L -1NaHCO3溶液的pH最接近于
| A.5.6 | B.7.0 | C.8.4 | D.13.0 |
把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
| A.0.1(b-2a)mol/L | B.10(2a-b)mol/L |
| C.10(b-a)mol/L | D.10(b-2a)mol/L |
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C 2AlN+3CO;下列叙述正确的是
2AlN+3CO;下列叙述正确的是
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为-3 |
| D.氮化铝晶体属于分子晶体 |