(12分,每空1分)下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:① ,⑥ ,⑦ 。
(2)画出原子的结构示意图:④ ,⑧ 。
(3)在①~⑫元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下⑦的单质和⑧的单质状态不同 b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是 (用元素符号表示),跟它同周期的ⅦA元素是 (用元素符号表示)
月球含有
、
、
、
、
、
等元素,是人类未来的资源宝库。
(1)
是高效核能原料,其原子核内中子数为。
(2)
的原子结构示意图为,
在氧气中完全燃烧所得产物的电子式为。
(3)
在工业上应用广泛,可由
制备。
①
的熔点比
的熔点(填"高"或"低")
②月球上某矿石经处理得到的
中含有少量
,除去
的离子方程式为;
的晶体类型为。
③
与炭粉和氯气在一定条件下反应可制备
。若尾气可用足量
溶液完全吸收,则生成的盐为(写化学式)。
(4)月壤中含有丰富的
,从月壤中提炼1
同时可得6000
和700
,若以所得
和
为原料经一系列反应最多可制得碳酸氢铵kg。
某兴趣小组以苯和乙烯为主要原料,采用以下路线合成药物普鲁卡因:
已知:
(1)对于普鲁卡因,下列说法正确的是。
| A. | 可与浓盐酸形成盐 | B. | 不与氢气发生加成反应 |
| C. | 可发生水解反应 | D. | 能形成内盐 |
(2)写出化合物
的结构简式。
(3)写出
反应所需的试剂。
(4)写出
的化学反应方程式。
(5)写出同时符合下列条件的
的所有同分异构体的结构简式。
①分子中含有羧基
②
谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子
(6)通常采用乙烯为原料制得环氧乙烷后与
反应合成
,请用化学反应方程式表示以乙烯为原料制备
的合成路线(无机试剂任选)。
煤炭燃烧过程中会释放出大量的
,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以
的形式固定,从而降低
的排放。但是煤炭燃烧过程中产生的
又会与
发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
 (反应Ⅰ)
(反应Ⅰ)
 (反应Ⅱ)
(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能自发进行的条件是。
(2)对于气体参与的反应,表示平衡常数
时用气体组分(
)的平衡压强
代替该气体物质的量浓度
,则反应Ⅱ的
=(用表达式表示)。
(3)假设某温度下,反应Ⅰ的速率(
)大于反应Ⅱ的速率(
),则下列反应过程能量变化示意图正确的是。
(4)通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由是。
(5)图1为实验测得不同温度下反应体系中
初始体积百分数与平衡时固体产物中
质量百分数的关系曲线。则降低该反应体系中
生成量的措施有。
A.向该反应体系中投入石灰石
B.在合适的温度区间内控制较低的反应温度
C.提高
的初始体积百分数
D.提高反应体系的温度
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,
,请在图2中画出反应体系中
随时间
变化的总趋势图。

分某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验:
另取10.80
在惰性气流中
(1)画出白色沉淀1中金属元素的原子结构示意图,写出气体甲的电子式。
(2)
的化学式是,在惰性气流中加热
至完全分解的化学反应方程式为。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是(用化学反应方程式表示)。
(4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式,并设计实验方案验证该反应的产物。
〔化学-选修5:有机化学基础〕(15分)
席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下: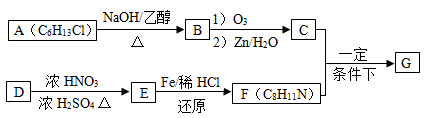
已知以下信息:
①
②一摩尔B经上述反应可生居二摩尔C,且C不能发生银镜反应。
③D属于单取代芳烃,其相对分子质量为106。
④核磁共振氢谱显示F苯环上有两种化学环境的
⑤
回答下列问题:
(1)由A生成B的化学方程式为,反应类型为
(2)D的化学名称是,由D生成E的化学方程式为:
(3)G的结构简式为
(4)F的同分异构体中含有苯环的还有种(不考虑立体异构)。其中核磁共振氢谱中有4组峰,且面积比为6:2:2:1的是。(写出其中的一种的结构简式)。
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。
反应条件1所选择的试剂为;反应条件2所选择的试剂为;I的结构简式为。